背景
フェレットは、生涯を通じて様々な腫瘍を発症しやすい種として知られています。国内飼育されているフェレットにおいて最も頻繁に診断される腫瘍は、内分泌系のインスリノーマや副腎皮質腫瘍、およびリンパ腫であり、これらが主要な罹患原因となります。皮膚および皮下組織の腫瘍は、これらの全身性疾患に次いで好発し、フェレットで最もよく見られる皮膚腫瘍には、肥満細胞腫と基底細胞腫の2つがあります〔Kanfer et al.2013〕。
肥満細胞は骨髄に由来します。他の造血細胞とは異なり、前駆細胞として骨髄から排出され、結合組織や粘膜などの様々な組織に侵入して初めて成熟します。肥満細胞は、免疫グロブリンE受容体との架橋反応によって脱顆粒し、ヒスタミンやサイトカインなどの化学物質を放出することで炎症を媒介します。この皮膚腫瘍の中でも、皮膚型肥満細胞腫(Cutaneous Mast Cell Tumors, cMCTs)は最も多く診断される腫瘍の一つで、フェレットにおいての挙動が特徴的であるため、確認しておくべき腫瘍疾患になります〔Williams et al.2020〕。
臨床的意義
肥満細胞腫は、免疫応答および炎症反応において重要な役割を担う肥満細胞(マスト細胞)の異常な増殖によって形成される腫瘍です。肥満細胞は、ヒスタミン、セロトニン、プロテアーゼなどの多様な生理活性メディエーターを細胞質の顆粒内に貯蔵しています。これらのメディエーターが腫瘍細胞から放出されること(脱顆粒)は、局所的な血管透過性の亢進や炎症、そして臨床的に観察される強い掻痒を引き起こします。また、腫瘍サイズが縮小したり(治癒したように見える)、数週間から数ヶ月後に再び増大したりする増減パターンも、メディエーター放出に起因する炎症反応の変動によって説明されることが多く、これはフェレットcMCTsの典型的な臨床徴候として認識されています。
イヌ、ネコ、フェレットにおける皮膚型MCTの相違点
獣医学領域において、肥満細胞腫はイヌの腫瘍学で最も悪性度が高く予測が難しい疾患の一つとして広く研究されています。イヌのMCTは病理組織学的なグレードに応じて極めて良性なものから、急速に転移・浸潤する高悪性度のものまで幅広い生物学的挙動を示します。ネコの場合、皮膚型MCTは一般にイヌよりも良性傾向にありますが、一部で悪性型も存在します。これに対し、フェレットの皮膚型肥満細胞腫は、イヌやネコのMCTとは根本的に異なる生物学的挙動を示します。フェレットのcMCTは普遍的に良性であり、転移能を持たない(非転移性)ことが広く報告されており、長期予後は極めて良好です。この根本的な予後の違いに基づき、フェレットのMCTに対する治療戦略は、イヌで採用されるような広範囲な根治手術や全身的な化学療法ではなく、局所病変の確実な除去と、掻痒による生活の質の低下(QOL)の管理に焦点が当てられます〔Williams et al.2020〕。
Table 1: イヌ、ネコ、フェレットにおける皮膚型肥満細胞腫の生物学的特徴比較
| 特徴 | イヌ | ネコ | フェレット |
| 悪性度スペクトラム | 低グレードから高グレードまで幅広い | 一般に低グレードが多いが、悪性型も存在する | 普遍的に良性 |
| 転移リスク | 高グレードでは高い | 比較的低いが、脾臓や内臓型では注意が必要 | 極めて稀、非転移性 |
| 治療目標 | 悪性度に応じた根治と延命 | 局所管理、一部で全身管理 | 局所病変の治癒的除去とQOL維持 |
| グレード分類 | Kiupel, Patnaikシステムなど、予後予測に重要 | 使用される | 臨床的な予後予測には適用されない |
発生
cMCTに伴う掻痒の程度は様々です。2つの研究では、雄の方がcMCTにかかりやすい可能性が示唆されていま〔Kanfer et al.2013,,Vilalta et al.2016〕。しかし、この知見を検証するための統計データは使用されていません。フェレットcMCTのほとんどの研究では、年齢の中央値は4~5歳とされていますが、2~9歳の範囲となる場合もあります〔Kanfer et al.2013,Vilalta et al.2016〕。
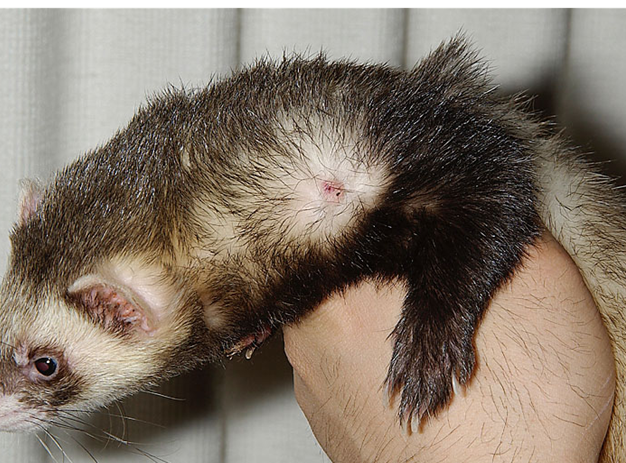
肉眼所見
フェレットのcMCTは良性と考えられており、遠隔転移は報告されていません〔Kanfer et al.2013,Vilalta et al.2016,Racnik et al.2018〕。肉眼的には、直径1~4mmの円形でプラーク状の独立した腫瘍として現れます〔Kanfer et al.2013,Vilalta et al.2016〕。フェレットのcMCTは、単一の病変の場合もあれば、複数の病変の場合もあります〔Vilalta et al.2016〕。表面はしばしば痂皮化、潰瘍化、または出血を伴います 。病変には、脱毛や過角化が認められることもあります。
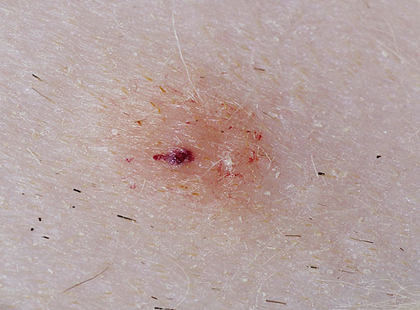
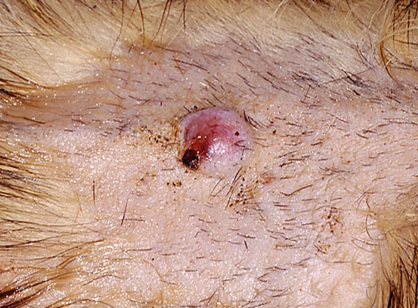
発生部位については特定の好発部位はなく、MCTは全身どこにでも発生し得ますが、典型的には体幹および頸部に多く見られます。この腫瘍の最も特徴的な臨床的挙動の一つは、サイズの変動性です。数週間から数カ月で病変が縮小・消失し、治癒したように見えた後、再び出現することがあります。この変動性のため、飼い主によって長期にわたり無視されるケースが存在します。腫瘍はしばしば掻痒を伴うため 、フェレットが掻いたり噛んだりすることで、二次的な自己外傷(潰瘍形成、痂皮形成、感染)が引き起こされます。
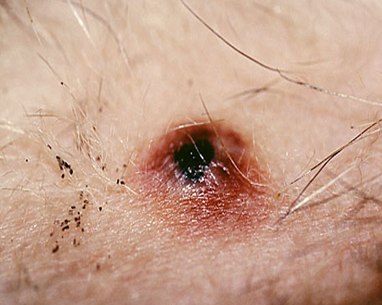
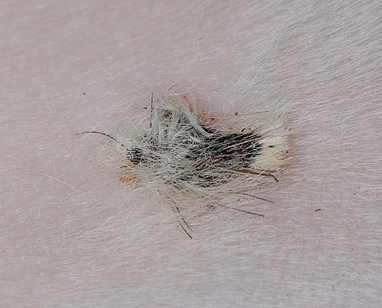
臨床現場においては、腫瘍自体の大きさや悪性度よりも、この掻痒による生活の質の低下(QOL)や自己外傷の重症度が、治療介入を決定する最も重要な動機となることが一般的です 。腫瘍が小さく臨床症状が稀な場合は、積極的な治療を行わず、注意深く経過観察を行うことも許容されます。
内臓型肥満細胞腫の存在と意義
cMCTが圧倒的に多い一方で、非常に稀ではありますが、MCTが皮膚以外の内臓、特に脾臓で検出された症例が報告されています〔Williams et al.2020〕。フェレットのcMCTが良性挙動を示すことから、内臓型(脾臓など)MCTの生物学的挙動がイヌやネコの全身性マストサイトーシスのような攻撃的な挙動を伴うかについては、十分な文献的根拠が不足しています。しかし、フェレットではリンパ腫などの全身性悪性腫瘍の発生率が非常に高いため2、内臓に腫瘤が確認された場合は、皮膚型とは区別し、悪性腫瘍を疑った厳重な精査が必要となります。
病因
フェレットの腫瘍全般の病因として、飼育環境、遺伝的素因、および感染因子が仮説として提唱されています。しかし、フェレットのcMCTに特有の明確な病因は、現在のところ未解明のままです〔Williams et al.2020〕。イヌのMCTの腫瘍形成において、チロシンキナーゼ受容体であるKITをコードするc-KIT遺伝子の変異が、腫瘍の攻撃的な挙動を決定する上で重要な役割を果たすことが知られています。フェレットのcMCT細胞は、このKIT受容体を発現しています。発現パターンは、細胞膜に主に発現するパターンIと、細胞質内の発現を伴うパターンIIIのいずれかとして観察されます 12。しかしながら、フェレットにおける重要な分子病理学的知見として、これらのKIT発現パターンが、腫瘍の生物学的挙動や予後と相関しないことが報告されています。この事実は、イヌで見られるような悪性化を誘導するc-KITシグナル伝達経路が、フェレットにおいては機能的に異なるか、または厳格な細胞内抑制メカニズムによって悪性形質が発現しない状態にあることを強く示唆しています。KIT発現が存在するにもかかわらず腫瘍が転移能を持たないという事実は、フェレットのMCTが局所性・良性の疾患であり、KITを標的とする分子標的薬(チロシンキナーゼ阻害剤)による全身治療の適用は分子病理学的にほとんど正当化されないことを意味しています。したがって、治療戦略は局所病変の物理的な除去に特化すべきであると判断されます〔Vilalta et al.2016〕。
診断・検査
肥満細胞腫が疑われる病変の診断は、初期の臨床評価と、腫瘍の特性を把握するための細胞学的または組織学的な確認によって進められます。低侵襲な手技である細胞診(穿刺吸引細胞診, FNA)は、初期診断において最も有用なツールです。FNAにより、フェレットcMCTは他の哺乳類cMCTと同様に顆粒を有する円形細胞です。顆特徴的な顆粒を持つ細胞が検出されれば、迅速かつ非侵襲的にMCTの可能性を強く示唆することができます。FNAは迅速診断を可能にしますが、フェレットのMCT細胞の細胞質顆粒は、粒はトルイジンブルー(TB)染色やライト・ガイズマ染色(WG)で観察できますが、ロマノフスキー染色(Diff-Quik染色など)では顆粒が染色されないことが断続的に報告されていますでは十分に染色されないことが多いという技術的な問題があります〔Williams et al.2020,Vilalta et al.2016〕。この断続的な染色失敗により、臨床現場で細胞診を用いて腫瘍を確定診断することが困難になることがあります。
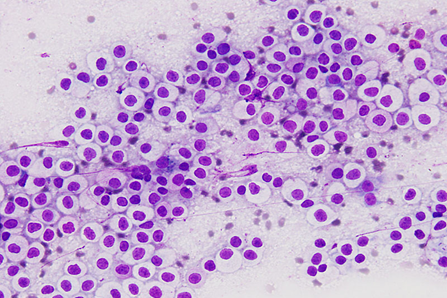
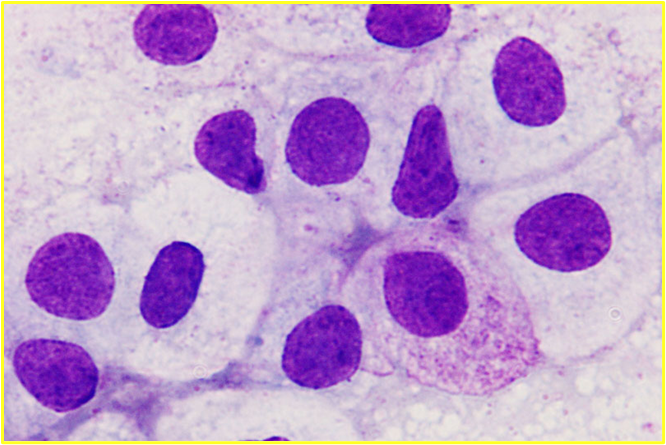
病理組織学的初見では、フェレットのcMCTの細胞質内の顆粒は様々に観察されます。ある研究では、微量の淡く染まる顆粒が認められました〔Kanfer et al.2013〕。別の研究では、cMCT顆粒は組織学的にはヘマトキシリン・エオジン(H&E)染色および結核染色では染色されなかったが、細胞学的には顕著な顆粒として染色されたと報告されています〔,Vilalta et al.2016〕。組織学的なH&E染色やトルイジンブルー(TB)染色で染色性が乏しいにもかかわらず、細胞診では顕著な顆粒が確認されることがあります 。この染色性の低さを踏まえ、臨床医は、顆粒が不明瞭に見える場合であっても、MCTの可能性を性急に排除すべきではありません。
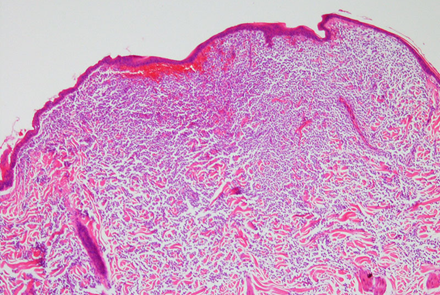
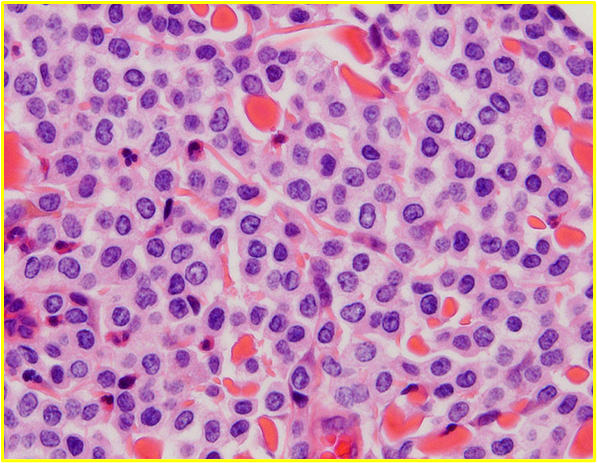
フェレットのcMCTは転移傾向がなく、良性挙動を示すため、イヌにおいて予後予測のために用いられるPatnaikシステムやKiupelシステムなどの悪性度グレード分類基準(細胞の異型性、核分裂像数、浸潤度を評価)は、フェレットにおいては臨床的な意味を持ちません。
治療
フェレットのcMCTに対する治療の標準的な第一選択は、完全外科的切除で、良性腫瘍であるため、マージンが確保されれば、手術は通常治癒的です。マージンについては、イヌの悪性MCTに必要な広範なマージン(2cm以上)は通常不要であり、ネコの低グレードMCTと同様に、腫瘍周囲の0.5cmから1cm程度の最小限のマージンを確保することで外科的治癒が得られることが多いとされています。
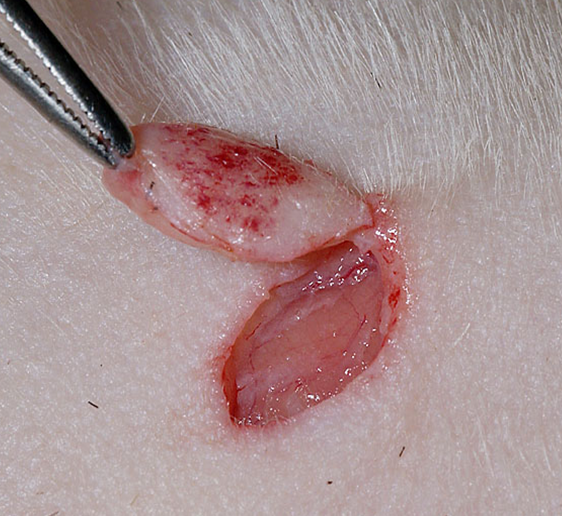
しかし、肢端部や尾部などの解剖学的に複雑な部位に腫瘍が発生した場合、適切なマージンを確保して切除すると、皮膚欠損が大きくなり、一次縫合による閉鎖が困難となるリスクが増大します。このような場合、欠損部を覆うために皮弁や皮膚移植が必要となったり、または二次治癒を待つ選択を強いられることがあります。
良性の皮膚型MCTに対して、全身的な化学療法や放射線療法は通常、推奨されません。しかし、肥満細胞の脱顆粒によって引き起こされる掻痒や炎症の管理のためには、薬物療法が重要となります。H1およびH2抗ヒスタミン薬は、腫瘍から放出されるヒスタミンの作用を抑制し、掻痒を軽減するために使用されることがあり、自己外傷を防ぎ、QOLを改善するために重要な付随的治療となります。また、ECTや外科手術の前後には、疼痛および炎症管理のために非ステロイド性抗炎症薬(NSAIDs)が処方されます。
電気化学療法(ECT)
外科的切除が困難な解剖学的部位に発生したMCTや、麻酔リスクが高いフェレットに対し、電気化学療法(Electrochemotherapy, ECT)は、有望な低侵襲性の代替治療法として注目を集めています。ECTは、ブレオマイシンなどの抗がん剤を腫瘍内に局所注射し、その後、電気パルスを用いて細胞膜透過性を一時的に亢進させることで、薬剤の細胞内取り込み効率を劇的に高める治療法です。報告された臨床事例では、ブレオマイシンを使用したECTを1セッション適用した結果、外科的に困難な部位(例えば、飛節や尾根部)に位置するMCTに対して、完全奏効が確認されています。奏効した腫瘍は数ヵ月にわたり再発が見られていません(例:11ヶ月〜15ヶ月の無再発期間) 。このECTの導入は、フェレットのMCT治療におけるQOL重視のパラダイムを具体化するものです。外科的切除に伴う大きな皮膚欠損(グラフトや二次治癒が必要)を回避しつつ、治癒的な局所制御を低侵襲で達成できるため、特に解剖学的に複雑な部位の腫瘍に対しては、ECTが第一選択肢として考慮されるべきであるという知見が確立されつつあります。ECT処置は比較的安価であり、患者の忍容性も高いことが示されています〔Racnik et al.2017〕。
参考文献
- Racnik J et al.Electrochemotherapy with Bleomycin of Different types of Cutaneous Tumours in a Ferret (Mustela Putorius Furo).Radiol Oncol 7;52(1):98–104.2017
- Kanfer S,Reavill DR.Cutaneous neoplasia in ferrets, rabbits, and guinea pigs. Vet Clin North Am
Exot Anim Pract16(3):579-598.2013 - Racnik J, Svara T, Zadravec M, et al. Electrochemotherapy with Bleomycin of Different types of
Cutaneous Tumours in a Ferret (Mustela Putorius Furo).Radiol Oncol52(1):98-104.2018 - Vilalta L,Meléndez-Lazo A,Doria G et al.Clinical,Cytological,Histological and Immunohistochemical Features of Cutaneous Mast Cell Tumours in Ferrets (Mustela putorius furo).J Comp Pathol155(4):346-355.2016
- Vilalta L,Meléndez-Lazo A,Doria G,Ramis A,Solano-Gallego L,Pastor J,Martorell J.Clinical, Cytological, Histological and Immunohistochemical Features of Cutaneous Mast Cell Tumours in Ferrets (Mustela putorius furo).J Comp Pathol155(4):346-355.2016
- Williams BH,Wyre NR.Neoplasia in Ferrets.Ferrets, Rabbits, and Rodents 29:92–108.2020