取り扱いと拘束
動物に危害を加えないように、しっかりと尚且優しく扱います。必要に応じて片方の手で頭を押さえ、もう片方の手で身体を押さえます。口、四肢および爪、尾などで攻撃する個体には注意しないと怪我を負います。一部のトカゲでは逃走手段として尾を自切することができるため、尾で動物を拘束することは避けなければいけません。ヤモリなど繊細な種類を扱う場合は柔らかい布などが役立ちます。トカゲの頭にタオルをかぶせて視界を制限すると、取り扱いや検査が容易になり効果的です。眼瞼を閉じた状態で両眼球に軽く圧力をかけると、イグアナやオオトカゲを数分分間または刺激が加えられるまで鎮静状態にすることができます。動物をうつぶせに寝かせ、光の強度を下げるあるいは遮断して暗くすると、大人しくなります。カメの頭を地面に向けて持つと、甲羅から頭が突き出して、甲羅内に収納されるのを防ぎます。より攻撃的な種に対しては、必要に応じて化学的な拘束手段を使用します。特にストレスがかかったり痛みを引き起こしたりする可能性のある場合は鎮静・麻酔の処置が必要になります。手動による強制的な拘束により、心拍数と血圧が大幅に上昇し、麻酔薬の心血管系への影響が懸念されます。

麻酔
麻酔は鎮静や鎮痛などを目的とした前投与薬を投与し、その後に維持麻酔を施します。
麻酔前投与
様々な麻酔前投与薬の報告がありますが、ここではその一部を紹介します。
アルファキサロン
静脈内または骨内の投与により、迅速な鎮静が得られます。筋肉内注射は、高用量で使用すれば効果的です。
ケタミンとデクスメデトミジンの併用
ケタミン/デクスメデトミジン/ヒドロモルフォンの筋肉内注射はカメ類に効果的であり、アチパメゾール、ナロキソン、またはナルトレキソンで可逆的に作用します。
| 薬剤 | 投与量 | コメント |
| ミダゾラム | 1.5-2.0mg/kg IM SC | 単独では軽度の鎮静のみ、ケタミンなど多剤併用で使用 |
| デスクメデトミジン+ミダゾラム | 0.025-0.1+1.0mg/kg IM SC | 軽度~中程度の鎮静 |
| デスクメデトミジン+ミダゾラム+ケタミン | 0.025-0.1+1.0+2.5-5mg/kg IM SC | 中程度~深い鎮静 |
| デスクメデトミジン+ケタミン | 0.025-0.7+5-10mg/kg IM SC IV | 深い鎮静~軽い麻酔 |
| プロポフォール | 2ー5mgkg IV | 中程度鎮静~軽い麻酔 |
| 薬剤 | 投与量 | コメント |
| プロポフォール | 5.0‐10.0mg/kg IV IO | 導入剤 最小限投与で30分は維持 |
| イソフルラン | 2.5‐5.0% | 5%で導入 2‐3%で維持 |
| セボフルラン | 2.5‐8.0% | 導入は7‐8%、維持は2.5‐4.5% |
| ケタミン | 5‐10mg/kg IM | 吸入麻酔の息こらえを予防できる |
| デスクメデトミジン+ケタミン | 0.05‐0.07+5.0-15.0mg/kg IM SC IV | |
| アルファキサロン+デスクメデトミジン | 30+0.1mg/kg SC | 全身麻酔は30~35分 10~12分後に回復 |
| ケタミン+メデトミジン | 100+0.2mg/kg IM |
| 薬剤 | 投与量 | コメント |
| ミダゾラム | 1.5-2.0mg/kg IM SC | 鎮静効果は最小限 効果は不安定 イソフルランのMACを下げる |
| テラゾール | 2.5-5.0mg/kg IM SC | 軽度~中程度の鎮静 挿管 大型のヘビに使用 |
| ケタミン | 5.0-10.0mg/kg IM SC | 軽度~中程度の鎮静 挿管 チャンバー導入中の息こらえを阻止 |
| プロポフォール | 3ー5mgkg IV | 中程度鎮静~軽い麻酔 |
| アルファキサロン | 10-20mg/kg IV SC IM | 簡単な処置 挿管 導入 頭側1/3投与が効果的 |
爬虫類の筋肉注射投与
トカゲ類およびカメ類では、前肢の筋肉への筋肉内注射が推奨されます。ヘビ類では、上肢の筋肉への筋肉内注射が推奨されます。
麻酔
爬虫類における注射麻酔薬は比較的投与が容易ですが、麻酔効果が長引く場合があり、投与後は予測できないことがあります。また、回復に数日かかる場合もあるため、可能な限り維持麻酔には吸入麻酔薬を選択するべきで、安全性が高いイソフルランが好まれます。
吸入麻酔薬
誘導には誘導チャンバー、バッグ、またはマスクを使用し、ある程度の大きさであれば気管挿管も可能です。カメ類は長時間呼吸を止めることができるため、この種の動物では吸入麻酔による導入が困難です。また、肥満な爬虫類は代謝が低いため、吸入麻酔の導入に時間がかかることがあります。爬虫類における吸入麻酔薬を使用する際に覚えておくべき 2つの重要な事項があります。まず、爬虫類は低い酸素分圧で呼吸することです。挿管された爬虫類の回復には、純酸素で見られるような回復の長期化を防ぐため、室内空気または酸素濃度100%未満の空気の使用が推奨されます。そして、爬虫類は酸素を必要とする標準的な代謝をバイパスすることができることです。不十分な自己呼吸や息止め、あるいは定期的な間欠的陽圧換気は、爬虫類が嫌気呼吸を利用する原因となる可能性があり、患者が酸素を摂取せずに麻酔が効かなくなる可能性があります。その結果、麻酔レベルが不適切となり、手術中の切開などの有害刺激に対する反応が損なわれます。結論的に何が理想なのかは状況によりますが、純酸素による回復はせず、可能な限り自己呼吸で麻酔をかけることがポイントになります。
| 薬剤名 | 投与量 | コメント |
| デスクメデトミジン+ミダゾラム+ケタミン+ヒドロモルフォン | 0.025‐0.05+0.5+2.0‐10.0+0.5mg/kg IM SC | 吸入麻酔併用 |
| デスクメデトミジン+ミダゾラム+ケタミン | 0.1+1.0+10.0mg/kg IM | ハコガメで軽度の麻酔40分 アカアシガメで深い鎮静~軽度の麻酔 |
| デスクメデトミジン+モルヒネ+ケタミン | 0.025‐0.1+1.5+5.0‐20.0mg/kg IM SC | 手術麻麻酔 |
| ケタミン+ジアゼパム | 100+2.0mg/kg IM | 効果も早く、回復も早い |
| プロポフォール | 2.0‐20.0mg/kg IV | 導入剤 大型のカメでは低用量 |
| イソフルラン | 2‐5% | 5%で導入、2-3%で維持 |
| セボフルラン | 2.5‐8・0% | 導入は7‐8%、維持は2.5‐4.5% |
| 薬剤名 | 投与量 | コメント |
| デスクメデトミジン+ミダゾラム | 0.05-0.1+1.0mg/kg IM SC | 中程度の鎮静 |
| デスクメデトミジン+ミダゾラム+ケタミン | 0.05-0.1+1.0+2.5-5mg/kg IM SC | 深い鎮静 |
| プロポフォール | 3.0-5.0mg/kgIV IO | 深い鎮静~軽度麻酔 |
| アルファキサロン | 15mg/kg IV SC IM IC | 深い鎮静~軽度麻酔 |
| 薬剤 | 投与量 | コメント |
| プロポフォール | 3‐10mg/kg IV | 導入 最小限投与で20-30分の効果 |
| イソフルラン | 2.0‐5.0% | 5%で導入 2-3%で維持 |
| セボフルラン | 2.5‐8.0% | 7-8%で導入 2.5-4.5%で維持 |
| 薬剤 | 投与量 | コメント |
| アチパメゾール | 投与したデスクメデトミジンの10倍量 SC IV IP | |
| フルマゼニル | 0.05mg/kg SC IV IM | 13:1 ミダゾラム:フルマゼニル |
| ナロキソン | 0.04mg/kgSC IM |
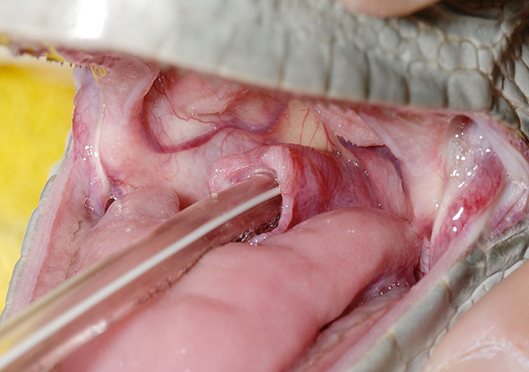
気管挿管
爬虫類の中には、声門と気管が前側にあり、容易に観察できるため、事前に鎮静剤や麻酔剤を投与しても投与しなくても挿管できるものもいます。爬虫類に挿管をすれば(カフ無し、または膨張させていない気管内チューブを使用)すれば、麻酔深度の調節が可能になり、維持管理には、この方法が最適です。カメ類では、動物を仰向けにすると、換気がない場合に肺活量が低下することがあります。気管挿管をしているならば、補助換気を行うことで、肺活量と肺機能を補助することができます。
保温
麻酔導入、維持、そして回復には、各爬虫類の至敵環境温度範囲の平均または上限値で実施する必要があります。種固有の範囲が不明な場合は、25~34℃の範囲で実施します。保温には循環式温水ブランケットの使用が理想です。電気カイロは熱傷のリスクがあり、使用を避けてください。もし使用する場合は、火傷を防ぐため、動物と熱源の間にタオルやドレープを挟んでください。
絶食
爬虫類の麻酔前の絶食期間は様々で、小型爬虫類では2~4時間、大型動物では24~72時間、一部のヘビでは3~15日間です。一般的に、手術前には1回の給餌サイクルをスキップする必要があります。絶食は逆流の可能性を減らし、肺の圧迫を防ぎ、換気を促進します。これは、換気が内臓容積の影響を受けるためです。
イソフルランのオープンドロップテクニック
ドラフト内にある 10 ガロンの水槽に、綿球に浸したイソフルラン 5 ~ 10 ml を入れます。10 ~ 30 分間の麻酔なら可能かもしれません。ただし、爬虫類が麻酔剤の滲みた綿球に触れないようにしてください。
麻酔モニタリング
爬虫類では、筋肉の弛緩は頭側から尾側へと進行し、麻酔からの回復時には逆の順序で回復します。麻酔深度が増すにつれて、正向反射ならびに立ち直り反射は消失します。粘膜色は酸素灌流と心拍出量を評価するために使用される場合がありますが、アオジタトカゲのように通常ピンク色の粘膜を持たない種では誤解を招く可能性があります。心電図モニター、ドップラー血流モニター、またはパルスオキシメーターの使用が役立つ場合がありますが、装着しても反応しないことが多々あります。爬虫類では聴診器で心音をモニタリングするのは困難で、食道聴診器は使いやすく、心拍数のモニタリングに役立つ場合があります。心臓や呼吸の動きを視覚化したり触診したりすることは難しいかもしれませんが、機械によるモニタ-が反応しない場合は試みるべきです。ほとんどの種では、1 分間に 2 ~ 4 回の呼吸で十分です。角膜反射は、角膜を眼鏡で覆っているヘビを除くすべての爬虫類において、手術レベルの麻酔深度でも残存します。ヘビの舌引き込み反射は、手術レベルの麻酔深度でも残存します。カメの頭と四肢を引っ込めるは、筋反射の評価になり、残っている時は麻酔の外科手術レベルではありません。

麻酔後ケア
可能な限り、爬虫類を暖かく暗い環境で観察します。至敵環境温度範囲の上限にあることを確認してください。必要であれば、爬虫類のつま先や尻尾をつまんで刺激し、回復中に動物が動いたり呼吸したりできるようにします。0.2~0.6 ml/kgのドキサプラムを静脈内または筋肉内投与すると、呼吸が刺激されます。麻酔から回復した後、少なくとも24時間は爬虫類を注意深く監視しなければなりません。
鎮痛
| 薬剤 | 投与量 | コメント |
| ブプレノルフィン | 0.005-0.2mg/kg IM | 24-48時間毎 |
| ヒドロモルフォン | 0.5mg/kg SC | フトアゴヒゲトカゲ 24時間毎 ミシシッピアカミミガメ12-24時間毎 |
| フルニキシンメグルミン | 0.1-0.5mg/kg IM | 24ー48時間毎(最大3日間) |
| メロキシカム | 0.1-0.5mg/kg PO SC IM | 24ー48時間毎(最大3日間) |
| 薬剤 | 投与量 | |
| リドカイン | 2ー5 | 最大5mg/kg以下 |
| ブピバカイン | 1ー2 | 最大4mg/kg以下 |
爬虫類における疼痛とその緩和については十分に解明されていないものの、痛みを伴う可能性のある処置を受けた爬虫類には鎮痛剤の使用が推奨される場合があります。ブプレノルフィン、フルニキシンメグルミン、メタカムは、爬虫類の術後鎮痛剤として使用されています。爬虫類の痛みの兆候は見分けるのが難しいです。兆候には以下のようなものがありますが、これらに限定されるものではありません。
- ひるむ
- 筋肉の収縮
- 噛もうとする
- 食欲不振
- 活動性の低下
- 減量
- 体色の変化(くすんだ色)
- 運動失調/跛行
- 呼吸数の増加
- 社会的孤立
- 患部を噛む
- 眼窩の窪み/閉瞼目/第三眼瞼挙上
先制鎮痛法を用いる場合は、麻酔薬(吸入薬または注射薬)の投与量を推奨範囲の下限まで減らすことを検討してください。麻酔深度は注意深くモニタリングする必要があり、適切な麻酔深度を維持するために薬剤の投与量を漸増する必要があります。

術後の回復とケア
麻酔からの回復期には、動物が自発呼吸をするまで15分ごとにモニタリングしてください。動物はインキュベーターまたは家庭用飼育施設に戻して歩行、立ち直り反射、そして種特有の行動を完全に回復させることができます。必要に応じて、鎮痛剤、水分、栄養、および温熱療法を追加で提供してください。
参考文献
- Adel, Milad et al.Anesthetic efficacy of ketamine-diazepam,ketamine-xylazine, and ketamine-acepromazine in Caspian Pond turtles(Mauremys caspica). Indian J Pharmacol:p93-97.2017
- Barrillot, Baptiste, et al.Intramuscular administration of ketamine-medetomidine assures stable anaesthesia needed for long-term surgery in the Argentine tegu Salvator merianae.J Zoo Wildl Med49:p291-296.2018
- Bennett RA. Anesthesia. In: Reptile Medicine and Surgery,DR Mader, WB Saunders Co:p241-247.1996
- Bennet RA,Mader DR.Soft Tissue Surgery.In Reptile Medicine and Surgery.Mader DR ed.WB Saunders Co:p287-291.1996
- Bertelsen Mads F et al.Pharmacodynamics of propofol and alfaxalone in rattlesnakes(Crotalus durissus). Comp Biochem Physiol A Mol Integr Physiol256.2021
- Carpenter JW.Chapter 4: Reptiles. In Exotic Animal FormularyElsevier Inc:p100-111.2013
- Carpenter JW.Pharmacotherapeutics in Reptiles: An Update and Review. In: Proceedings of 31st Annual Conference of the World Small Animal Veterinary Association, Prague,Czech Republic, pg. 321.
- Divers SJ et al.Pharmacokinetics of meloxicam following intravenous and oral administration in green iguanas (Iguana iguana). AJVR71:p1277-1283.2010
- Eshar D et al.Evaluation of the effects of a dexmedetomidine-midazolam-ketamine combination administered intramuscularly to captive red-footed tortoises(Chelonoidis carbonaria).Am J Vet Res82:p858-864.2021
- Ferreira, Tatiana H et al.Evaluation of neuraxial administration of bupivacaine in bearded dragons (Pogona vitticeps). Veterinary Anesthesia and Analgesia48:p798-803.2021
- Ferreira, Tatiana H, and Mans, Christoph. Evaluation of neuraxial anesthesia in bearded dragons (Pogona vitticeps). Veterinary Anesthesia and Analgesia46:p126-134.2019
- Freitag, Flavio AV et al.Alfaxalone for anesthesia of a giant snake.Veterinary Anesthesia and Analgesia49:p147-148.2022
- Gatson, Bonnie J et al.Intramusclar epinephrine results in reduced anesthetic recovery time in American Alligators (Alligator mississippiensis) undergoing isoflurane anesthesia. J Zoo Wildl Med48:p55-61.2017
- Guzman DSM.Reptile Analgesia and Anesthesia.Wildlife and Aquatic Animal Medicine Club Symposium.2013
- Hawkins Shawna J et al. Pharmacokinetics of subcutaneously administered hydromorphone in bearded dragons (Pogona vitticeps) and red-eared slider turtles (Trachemys scripta elegans). Veterinary Anesthesia and Analgesia46:p352-359.2019
- James, Lauren E et al.Anaesthetic induction with alfaxalone in the ball python (Python regius): dose response and effect of injection site.Veterinary Anesthesia and Analgesia45:p329-337.2018
- James, Lauren E et al.Evaluation of feeding behavior as an indication of pain in snakes.J Zoo Wildl Med48.2017
- Kleinschmidt Laura M et al.Randomized controlled trial comparing the effects of alfaxalone and ketamine hydrochloride in the Haitian giant galliwasp (Celestus warreni). J Zoo Wildl Med49.p283-290.2018
- Kristensen Line et al.Effect of atropine and propofol on the minimum anaesthetic concentration of isoflurane in the freshwater turtle Trachemys scripta (yellow-bellied slider).Veterinary Anesthesia and Analgesia50:p180-187.2023
- Martin, BJ. Evaluation of hypothermia for anesthesia in reptiles and amphibians. ILAR Journal37:p186-190.1995
- Miller, Lynn J et al.A fixed moderate-dose combination of tiletamine+zolazepam outperforms midazolam in induction of short-term immobilization of ball pythons (Python regius). PLoS one13.2013
- Mones Alissa B et al.Evaluation of lidocaine for brachial plexus blockade in eastern box turtles (Terrapene carolina carolina). Veterinary Anesthesia and Analgesia50:p98-101.2023
- Mosely C.Topics in Medicine and Surgery:Anesthesia and Analgesia in Reptiles. In: Seminars in Avian and Exotic Pet Medicine14(4):p243-262.2005
- Page CD.Current Reptilian Anesthesia Procedures.In Zoo and Wild Animal Medicine: Current Therapy 3, ME Fowler WB Saunders Co:p140-143.1993
- Pye G, Carpenter J. Ketamine Sedation followed by Propofol Anesthesia in a Slider, Trachemys scripta, to Facilitate Removal of an Esophageal Foreign Body Assoc Reptilian Amphibian Vet 81:16-17.1998
- Rasys Ashley M et al. A systematic study of injectable anesthetic agents in the brown anole lizard (Anolis sagrei). Lab Anim54.2020
- Ratliff, Cameron et al.Effects of the fraction of inspired oxygen on alfaxalone-sedated inland bearded dragons (Pogona vitticeps). Am J Vet Res80:p129-134.2013
- Rockwell, K et al.Evaluating the efficacy of alfaxalone in corn snakes (Pantherophis guttatus). Veterinary Anesthesia and Analgesia48 p364-371.2021
- Rooney TA et al.Evaluation of a dexmedetomidine-midazolam-ketamine combination administered intramuscularly in captive ornate box turtles (Terrapene ornata ornata). Veterinary Anesthesia and Analgesia, 2021, Vol 48, pp 914-921.
- Scheelings, T.F., et al. Anaesthesia of hatchling green sea turtles (Chelonia mydas) with intramuscular ketamine-medetomidine-tramadol. Aust Vet J98.2020
- Schumacher J. Reptiles and Amphibians. In: Lumb and Jones’ Veterinary Anesthesia, Third Edition, eds. JC Thurmon., WJ Tranquilli and JE Benson, Williams and Wilkins:p670-682.1996
- Sladky, K. and C. Mans. Topics in Medicine and Surgery: Clinical Anesthesia in Repties. In Journal of Exotic Pet Medicine21:p17-31.2012
- Warwick, Clifford, et al. Reevaluating the use of hypothermia for anesthetizing and euthanizing amphibians and reptiles. JAVMA253.2013
- Webb, Joanna K., et al. Use of alfaxalone in bearded dragons (Pogona vitticeps): optimizing pharmacodynamics and evaluating cardiogenic effects via echocardiography. JAVMA,261:p126-131.2022
- Williams, Catherine J.A., et al. The influence of assisted ventilation and recumbency on cardiorespiratory physiology in the anesthetized freshwater turtle Trachemys scripta scripta. Comp Biochem Physiol A Mol Integr Physiol260.2021
- Yaw TJ et al.Effect of injection site on alfaxalone-induced sedation in ball pythons (Python regius). J Small Anim Pract59.2018