臨床的意義
ウサギの臨床において、肝リピドーシス(Hepatic Lipidosis)、一般に脂肪肝と称される病態は、単なる肝臓の疾患ではなく、全身性の代謝破綻を象徴する緊急事態です。犬や猫などの肉食動物が数日間の絶食に対して比較的高い耐性を有するのに対し、草食動物であり、常に消化管内に食物を送り続けなければならない生理学的特性を持つウサギにとって、食欲不振は直ちに生命を脅かす危機な状態となります。特に肥満傾向にある飼育下のウサギにおいては、食欲廃絶からわずか12~24時間という短期間で体脂肪の急激な動員が始まり、肝臓の代謝能力を超えた脂肪酸が肝細胞内に蓄積することで、不可逆的な肝不全へと進行するリスクがあります。
解剖学的および生理学的背景
ウサギの肝臓および脂質代謝には、他の哺乳類とは異なるいくつかの重要な特徴が存在し、これらが肝リピドーシスへの感受性を高める要因となっています。
解剖学的特徴
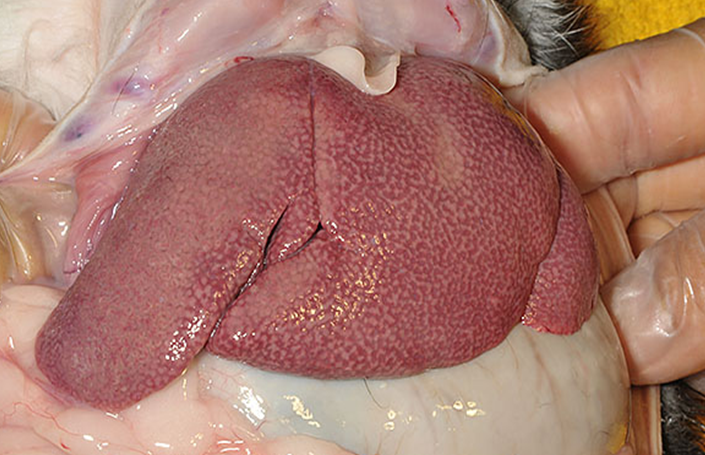
ウサギの肝臓は、腹腔内の前方に位置し、左右の葉が深い裂け目によって分かれています。具体的には、右葉、左葉、方形葉、尾状葉の4葉から構成され、さらに右葉と左葉は前部および後部の小葉に細分化されています。臨床的に特筆すべきは尾状葉の構造で、尾状葉は右腎臓の近傍に位置し、肝門部との付着部(茎)が非常に狭く細いという解剖学的特徴を有します。この構造的脆弱性により、尾状葉は物理的な変位や捻転を起こしやすく、これが虚血、壊死、そして急激な肝リピドーシスを誘発する一因となります〔Ozawa et al.C〕。
胆嚢は腹腔深部に位置し、胆管と膵管は別々の開口部を持って十二指腸に接続している。ウサギの胆汁分泌量は体重あたりで犬の約7倍(約250 mL/日)と極めて多く、活発な消化活動を支えていますが、これは同時に胆汁うっ滞が生じた際の影響が甚大であることを示唆しています。さらに興味深い点として、ウサギは胆汁色素としてビリルビンではなく、主にビリベルジンを分泌する数少ない哺乳類の一つです〔Donnelly 1997,Jenkins 2000〕。しかし、重度の閉塞性黄疸や肝不全の際には、酵素系の飽和によりビリルビン血症を呈することがあります。
脂質代謝
ウサギが肝リピドーシスを発症しやすい最大の生理学的要因は、脂質代謝、特に超低密度リポタンパク質(VLDL)の分泌機構と脂肪分解酵素の特性にあります。通常、絶食時には脂肪組織から遊離脂肪酸(NEFA)が動員され、肝臓に取り込まれてエネルギー源として利用されます。余剰な脂肪酸はトリグリセリドに再合成され、VLDLとして血中に放出されることで肝臓外へ輸送されます。しかし、ウサギの肝臓はこのVLDL分泌能力に限界があり、脂肪酸の流入速度がVLDLの合成・分泌速度を上回ると、トリグリセリドが肝細胞内に急速に蓄積する代謝のボトルネックが生じます〔DeCubellis et al.2013〕。さらに、ウサギは他の多くの種と異なり、肝性リパーゼ(Hepatic Lipase)の活性が先天的に欠損しているか、著しく低いという特異な代謝特性を持っています〔Zhang et al.2008〕。肝性リパーゼは、リポタンパク質の代謝や肝臓によるレムナント(代謝残り)の取り込みに重要な役割を果たしており、この酵素の欠損は脂質クリアランスの遅延や、脂肪肝形成への感受性を高める要因として議論されています〔Chang et al.1993 〕。肥満個体では、血漿NEFAから合成される肝トリグリセリドの割合が痩せた個体よりも有意に高く、肝臓内での脂肪合成が亢進していることが示されています〔Zhang et al.2008〕。
病態生理
肝リピドーシスの本質は、エネルギー需要と供給の不均衡に対する生体の適応不全で、負のエネルギーバランスから肝不全へ移行することが懸念されています。
脂肪動員の生化学的カスケード
ウサギが食欲不振や消化管うっ滞によりカロリー摂取不足に陥ると、血糖値を維持するためにインスリン分泌が低下し、グルカゴンやカテコールアミン、コルチゾールといったストレスホルモンの分泌が増加します。これにより、脂肪組織のホルモン感受性リパーゼが活性化され、貯蔵脂肪(トリグリセリド)がグリセロールと遊離脂肪酸(NEFA)に分解され、血中へ大量に放出される。血中のNEFAは肝臓へ流入し、ミトコンドリアでのβ酸化を経てエネルギー(ATP)を産生します。しかし、ウサギのβ酸化能力には限界があり、流入量が処理能力を超えると、酸化されなかった脂肪酸は再びエステル化され、肝細胞の細胞質内に脂肪滴として蓄積されます。これが物理的に細胞小器官を圧迫し、細胞機能を障害する(脂肪変性) 酸化経路が飽和すると、アセチルCoAはケトン体(アセト酢酸、β-ヒドロキシ酪酸、アセトン)の合成へと回される。ケトン体の蓄積は代謝性アシドーシス(ケトアシドーシス)を引き起こし、これがさらに食欲不振や中枢神経抑制(嗜眠、昏睡)を悪化させる悪循環を形成します〔Veenstra et al.2020,Reusch 2005〕。
肝機能障害の進行
脂肪滴の蓄積により肝臓は著しく腫大(肝腫大)し、黄色く脆弱になる。腫大した肝細胞は肝類洞を圧迫して微小循環を阻害し、肝実質の虚血と壊死を進行させます。機能不全に陥った肝臓は、解毒機能、糖新生、血液凝固因子の合成といった生命維持に不可欠な機能を喪失し、最終的には肝性脳症やDIC(播種性血管内凝固症候群)を併発して死に至ります〔DeCubellis et al.2013〕。
原因
肝リピドーシスは原発性の疾患であることは稀であり、通常は食欲不振を引き起こすあらゆる基礎疾患に続発します。最も一般的な原因は、消化管運動の低下(うっ滞)や毛球症で、低繊維・高炭水化物の不適切な食事、水分不足、運動不足などが誘因となり、消化管の蠕動運動が停滞します。うっ滞が生じると、ウサギは腹痛や不快感から食欲を失い、さらに盲腸内細菌叢のバランスが崩れ(ディスバイオシス)、ガス産生や毒素吸収が起こります。この負の連鎖が急速な脂肪動員を招く形に至ります。
ウサギの歯は常生歯であり、生涯伸び続ける。牧草などの繊維質摂取不足により摩耗が不十分になると、不正咬合が生じます。伸びすぎた歯牙の棘が舌や頬粘膜を傷つけ、口腔内の疼痛を引き起こします。この慢性的な痛みと摂食障害は、長期にわたるカロリー不足をもたらし、潜在的な肝リピドーシスのリスクとなります。
被食者であるウサギは、痛みや恐怖に対して、すくみ反応を示し、摂食活動を停止する傾向が強いです。捕食者の臭い、環境の急変、騒音、術後の疼痛などは、交感神経系を刺激して消化管運動を抑制し、食欲廃絶の引き金となります。ストレスによる高血糖は、この病態生理学的反応の一端を示しています。
尾状葉の捻転は急性腹症の原因となります。捻転による虚血と壊死、およびそれに伴う激痛と食欲廃絶により、二次的に肝リピドーシスが急速に進行します。
その他の要因として、肥満個体は体脂肪量が多いため、絶食時に動員される遊離脂肪酸の量が膨大であり、肝リピドーシスの発症リスクが極めて高いです。妊娠中毒症の一環として肝リピドーシスが見られることがある。胎児の成長や乳汁産生によりエネルギー要求量が増大しているため、わずかな摂食不良でも重篤な結果を招きます〔Melillo 2007〕。

検査・診断
確定診断には肝生検による病理組織学的検査が必要ですが、肝リピドーシスを呈するウサギは麻酔リスクが極めて高く、出血傾向も懸念されるため、臨床現場では単一の検査のみで診断するのではなく、病歴、身体検査、および複数の検査結果を統合して判断すべき症候群です。
身体検査
初期症状は非特異的であり、食欲低下、便の小型化や減少、活動性の低下が見られます。進行すると、重度の抑うつ、嗜眠、脱水が見られ、ショックに陥ります。これらは循環不全と代謝崩壊を示唆しします。肝腫大が触知されることがありますが、胃拡張やガス貯留により不明瞭な場合が多いです。腹部は鼓脹し、不快感や疼痛反応(歯ぎしり、背中を丸める姿勢)を示すこともあります。肝性脳症や低血糖、ケトアシドーシスにより、運動失調や痙攣、意識障害が見られます。肥満傾向のウサギにおける、疼痛、歯科疾患、ストレスなどが原因での突然の食欲廃絶(12-24時間以上)のような条件からも、発生が憶測されます。

血液検査
血液生化学検査
肝酵素の上昇および代謝マーカーの異常は診断の重要な手がかりとなるが、ウサギ特有の解釈が必要となります〔Varga 2013〕。肝リピドーシスの本質である脂質代謝異常を直接反映する項目は、早期診断において重要です。 確実なGGTの上昇、高脂血症(乳び血清)、BHBAの高値を確認することが優先され、ALTやASTの上昇は参考程度とします。
| 項目 | 意義 |
| ALT (Alanine Aminotransferase) | ALTは肝細胞質に存在する酵素であり、肝細胞膜の透過性亢進や壊死により血中に逸脱する。しかし、ウサギにおいてALTは肝臓特異的ではなく、心筋、骨格筋、腎臓などにも広く分布しているため、単独での上昇は必ずしも肝疾患を意味しない。〔Meredith et al.2000〕 半減期: ウサギのALT半減期は約5時間と極めて短い(犬は約45〜60時間)。そのため、急性肝障害が発生しても採血のタイミングによっては基準値内に留まる可能性があり、感度は低いとされ〔Meredith et al.2000〕る。 診断基準: 有意な上昇(基準値の数倍以上)が認められ、かつCK(クレアチンキナーゼ)の上昇を伴わない場合、肝細胞壊死(肝リピドーシス、肝葉捻転、コクシジウム症、中毒など)を示唆する〔Meredith et al.2000〕 |
| AST (Aspartate Aminotransferase) | 特異性: ASTも同様に肝、心筋、骨格筋、赤血球、膵臓、腎臓など広範な組織に分布する〔Meredith et al.2000〕。 診断基準: 肝リピドーシスにおいては、肝細胞の物理的腫大や脂肪毒性による壊死に伴い上昇するが、保定による筋肉損傷や採血時の溶血などでも容易に上昇するため、特異性は低い。ALTと同様、CKとの併用評価が必須である〔Meredith et al.2000〕。 |
| ALP (Alkaline Phosphatase) | 多臓器由来: ウサギのALPは、肝臓(胆管上皮)、骨(骨芽細胞)、小腸粘膜、腎臓、胎盤など複数のアイソザイムが存在する。特に腸管由来および腎由来のALP活性が高く、肝特異性は極めて低い〔Meredith et al.2000〕。 診断基準: 肝リピドーシスに伴う胆汁うっ滞で上昇するが、成長期、食餌内容、消化管うっ滞、骨疾患などでも上昇するため、診断的価値は限定的であ〔Meredith et al.2000〕る。 |
| GGT (Gamma-Glutamyl Transferase) | 特異性と信頼性: ウサギの肝リピドーシス診断において、GGTは最も信頼性の高い酵素マーカーの一つである。GGTは腎臓にも高濃度で存在するが、血中に逸脱するGGTは主に肝由来であると考えられている〔Meredith et al.2000〕。 メカニズム: 脂肪蓄積による肝細胞の腫大が胆細管を圧迫し、微細な胆汁うっ滞(intrahepatic cholestasis)を引き起こすことでGGTの上昇が誘導される。 診断基準: 正常ウサギ(New Zealand White種など)の基準値(0-31 U/L程度)を超えて上昇する場合、肝リピドーシスや胆管閉塞、肝葉捻転の可能性が高い〔Meredith et al.2000〕。 |
| 総ビリルビン (Total Bilirubin) | ビリベルジン優位: ウサギはビリベルジン還元酵素の活性が低く、ヘムの主要な分解産物としてビリルビンではなく「ビリベルジン(緑色色素)」を胆汁中に排泄する〔Meredith et al.2000〕。 黄疸の欠如: したがって、ウサギは重度の肝不全や肝リピドーシスが存在しても、組織の黄染(黄疸)や血清総ビリルビンの上昇を示さないことが多い〔Meredith et al.2000〕。 診断基準: もし血清ビリルビン値の上昇や可視粘膜の黄疸が認められた場合、それは予後不良の徴候であり、完全胆管閉塞や末期的な肝壊死、あるいは肝葉捻転を示唆する。 |
| 血糖値 (Glucose) | ストレス性高血糖: ウサギは痛みやストレス(消化管うっ滞や閉塞など)に対し、カテコラミン放出による著しい高血糖(>300-400 mg/dL)を示す。これはインスリン抵抗性を惹起し、脂肪分解をさらに促進する悪循環を生む〔Meredith et al.2000〕。 低血糖: 末期の肝不全により肝臓の糖新生能が枯渇すると、低血糖に転じる。これは死期が切迫していることを示す予後不良因子である〔Meredith et al.2000〕。 |
| コレステロール・トリグリセリド | 高脂血症: 肝臓からのVLDL分泌障害や末梢からの脂肪動員過多により、血清トリグリセリドおよびコレステロール値の上昇が認められる。 血清性状: 重度の症例では、採血した血清が白濁(乳び、Lipemia)を呈する。これはVLDLやカイロミクロンの著しい増加を示唆し、肝リピドーシスの強力な傍証となる〔Meredith et al.2000〕。 |
| ケトン体 (Ketones) | ケトーシス: 絶食による脂肪酸酸化の亢進により、肝臓でケトン体(アセトン、アセト酢酸、β-ヒドロキシ酪酸)が産生される〔Meredith et al.2000〕。 BHBAの有用性: β-ヒドロキシ酪酸(BHBA)は、アノレキシアを呈するウサギにおいて、肝リピドーシスのリスクや進行度を評価するバイオマーカーとして有用である〔Meredith et al.2000,Melillo 2007〕。 診断基準: 犬猫用の簡易測定器を用いた研究では、アノレキシア群におけるBHBAの上昇が確認されており、これが高値を示す場合は積極的な栄養管理が必要であることを示唆する。尿検査によるケトン体(アセト酢酸)の検出も有用であるが、BHBAの方が代謝状態をより鋭敏に反映する可能性がある〔Meredith et al.2000〕。 |
血液学的検査
貧血(PCVの低下)が見られることがあります。これは慢性疾患に伴う貧血や、肝機能低下による造血因子の不足、あるいは肝捻転に伴う腹腔内出血などが原因となります。中等度から重度の貧血は、肝捻転症例において7日以内の死亡リスクを高める因子として報告されています〔Varga 2013〕。
画像診断
肝リピドーシスになると肝臓の腫大が起こることから、X線では肝陰影の拡大を確認します。超音波やCT検査で肝細胞の脂肪変性を評価できます。
X線検査
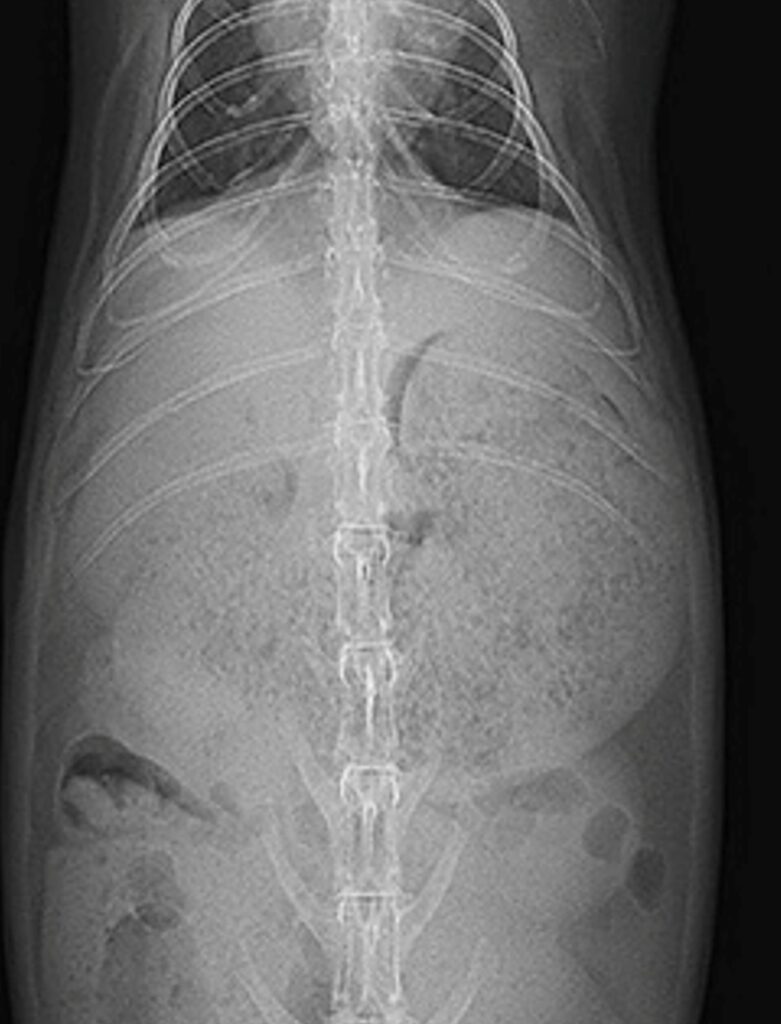
X線検査は、腹部全体の概観を得るための一次スクリーニングとして実施されます。肝臓の内部構造を評価することはできませんが、肝臓のサイズ、形状、位置の変化、および併発疾患(消化管うっ滞、胃拡張、結石など)の有無を評価するために不可欠です。
正常肝臓像
ウサギの腹腔内には多量の脂肪が存在することが多く、これが臓器間のコントラスト(Serosal detail)を形成します。正常な肝臓は横隔膜と胃の間に位置し、側方像(ラテラル像)において肝臓の後縁は肋骨弓を超えないのが一般的です。しかし、胸郭の深さや呼吸相によって見え方が変化するため、主観的な評価になりがちです。
肝腫大の評価
脂肪蓄積により肝臓の体積が増大すると、辺縁の形状変化が見られ、 正常な肝臓の辺縁(特に腹側尾側縁)は鋭利ですが、肝リピドーシスにより腫大すると、辺縁が丸みを帯びてきます。肋骨弓からの逸脱は腫大の可能性が高いです。そして、肝腫大の最も信頼性の高い間接的所見の一つが胃の変位です。側方像において、腫大した肝臓が胃を尾側および背側へ、VD像では尾側へシフトさせます。

超音波検査
超音波検査は、X線検査では評価できない肝臓の実質構造を観察できるため、肝リピドーシスの診断において最も実用的かつ感度の高い非侵襲的検査法になります。
正常肝臓像
正常なウサギの肝実質のエコー源性は均質で中等度のエコーレベルを有します。肝腎コントラストとして、正常な隣接する右腎皮質と同等か、わずかに高い程度になります。 門脈や肝静脈は、周囲の肝実質に対して低エコー(黒色)の管腔構造として明瞭に描出され、門脈壁は高エコー(白色)の縁取りが確認できます。
肝リピドーシス像
肝実質の高エコーならびに肝腎コントラストの増大を確認し、脂肪肝の診断を固めます。
びまん性高エコー像(Bright Liver)
脂肪滴は超音波ビームを強く散乱させる性質を持つため、脂肪が蓄積した肝臓は特徴的な高エコー像を呈します。そのため、肝実質全体が白く輝いて見えます(Bright liver)。肝臓のエコーレベルが、右腎皮質よりも明らかに高くなります。この肝腎コントラストの増大は、脂肪肝を示唆する強力な定性的指標となります。
超音波減衰と深部描出能の低下
脂肪組織による超音波の散乱と吸収の増加により、深部へのビーム到達が妨げられます。肝臓の浅層(プローブ側)は高エコーであるが、深部に行くにつれて急激にエコーレベルが低下し、黒く見える。これにより、肝臓の最深部や横隔膜のラインが不明瞭になります。 高エコー化した肝実質の中に、本来見えるはずの門脈壁や肝静脈の境界が埋もれてしまい、血管構造の描出が困難になります。
肝腫大と辺縁の丸み
X線検査と同様、肝腫大による辺縁の鈍化や、腹腔内臓器の圧迫・変位がリアルタイムで観察されます。
CT検査
CT検査(Computed Tomography)は、X線吸収値(CT値)を用いて組織密度を絶対的な数値として評価できるため、脂肪肝の重症度判定において最も客観的かつ精度の高い非侵襲的検査法です。
CT値(Hounsfield Units: HU)による診断
診断が不確定な場合や、腫瘍性疾患との鑑別が必要な場合にCT検査を実施します。脂肪のCT値は約-100 HUであり、肝細胞内に脂肪が蓄積すると、肝実質全体のCT値が低下します。
正常肝のCT値
健康なウサギの肝臓の非造影CT値(Plain CT)は、概ね45〜65HUの範囲にあります〔Kawata et al.1984〕。 正常な状態では、肝臓のCT値は脾臓のCT値と同等か、わずかに高いです。
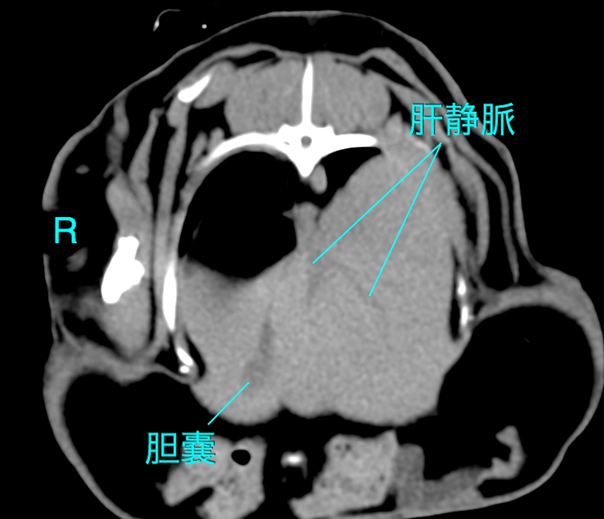
脂肪肝のCT値
ウサギを用いた実験的脂肪肝モデルの研究により、肝臓のトリグリセリド含有量とCT値の間には強い負の相関があることが証明されています。 軽度脂肪肝では 正常値からの低下は軽微であり(数HUの低下)、視覚的な判定は困難な場合があります。中等度〜重度脂肪肝では肝臓のCT値が 40 HU未満 に低下した場合、脂肪肝と診断されるます。 重症例では 0 HU に近づき、さらに進行するとマイナス値(例:-15 HUなど、脂肪組織に近い値)を示すこともあります。 脂肪乳剤の投与や治療介入による改善・悪化を、CT値の経時的変化(10-20 HUの変動など)として定量的にモニタリングすることが可能です〔Kawata et al.1984〕。
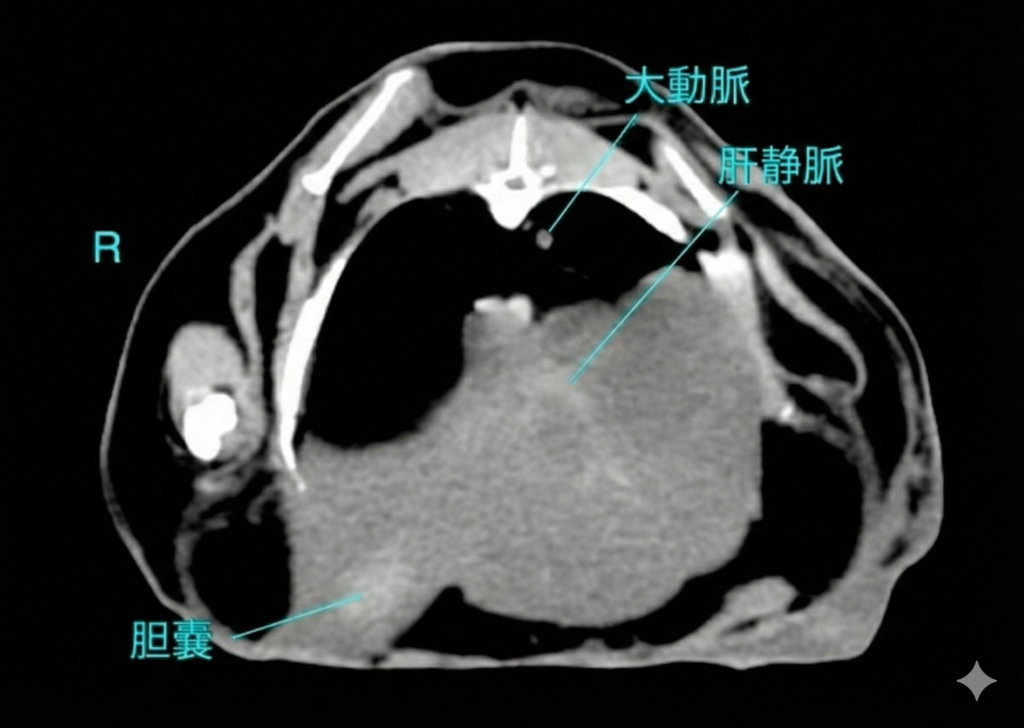
造影CT検査の有用性と限界
脂肪含有量の定量評価には、造影剤の影響を受けない非造影CTの方が適しています。造影後は、血流動態や造影タイミングによってCT値が変動するため、脂肪評価の相関が弱くなるからです。 肝腫瘍や膿瘍、肝葉捻転の診断には造影撮影が不可欠です。特に肝葉捻転では、患部肝葉の造影効果欠損が明瞭に描出されるため、全体的に造影される(が密度は低い)脂肪肝との鑑別が可能となります。
細胞診と病理組織学的検査
画像診断や血液検査は強力なツールですがが、確定診断には細胞レベルでの脂肪滴の証明が必要となる。
細針吸引生検(FNA)
超音波ガイド下で22-25Gの細針を用いて肝実質から細胞を吸引します。比較的低侵襲であり、無麻酔または軽度鎮静下で実施可能です。 肝細胞質内に大小不同の明調な空胞が多数認められます。Diff-Quik染色などで空胞として抜けて見えるが、脂肪であることを証明するには未固定標本に対するオイルレッドO染色(Oil Red O stain)が必要となります。 しかし、肝リピドーシスにより脆弱化した肝臓は出血しやすいため、凝固能の評価が推奨されます。
組織生検
組織構造の保持、炎症の有無、線維化の程度などを評価できるが、全身麻酔と開腹あるいは腹腔鏡が必要となるため、状態の悪い脂肪肝症例ではリスクが高いです。
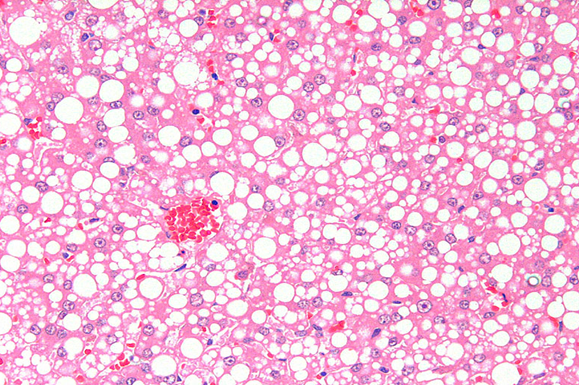
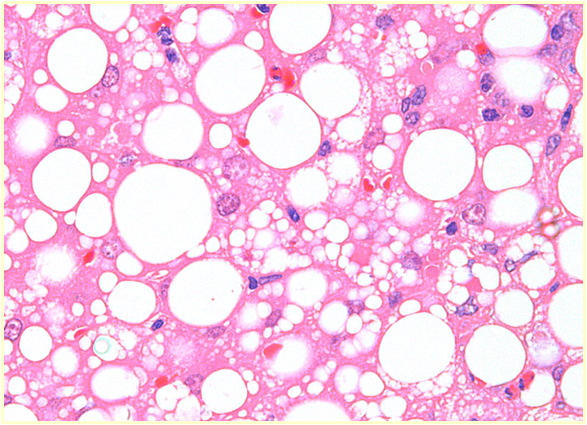
治療
肝リピドーシスの治療は時間との戦いです。治療の主要な目的は、負のエネルギーバランスの是正(栄養補給)、脱水と電解質異常の補正、および基礎疾患の治療になります。これらを同時に、かつ攻撃的に行う必要があります。
栄養管理
食欲不振が12時間を超えた時点で、肝リピドーシスの進行を阻止するために強制給餌を開始すべきです。自発的な採食を待つことは、病状を悪化させるだけです。
エネルギー要求量の計算
給餌量は、ウサギの安静時エネルギー要求量(Resting Energy Requirement: RER)に基づいて決定します。 ウサギのRER算出にはいくつかの式が提案されていますが、一般的には以下の式が用いられています〔Nutritional Guidelines For Feeding Pet Rabbit〕。
RER (kcal/day) = K× (体重 kg}0.75
ここで係数 K は、犬猫で用いられる70よりも高く、ウサギの高い代謝率を反映して 100 が推奨されることが多いです(例:2kgのウサギで約168 kcal/日)〔Nutritional Guidelines For Feeding Pet Rabbit〕。成長期や妊娠・授乳期にはさらに係数を乗じて必要量を算出します。
給餌方法
嚥下が可能で、ストレス耐性がある個体には、市販の草食動物用流動食を水で溶き、シリンジで経口投与する。重度の食欲不振、強制給餌への激しい抵抗、あるいは頻回な給餌が必要な場合には、経鼻カテーテルの留置が推奨されます。5〜8 Frのポリウレタン製またはシリコン製チューブを使用します。局所麻酔薬(リドカインゲルなど)を使用し、鼻腔から胃まで挿入し、レントゲンで位置を確認した上で縫合または接着剤で固定します。 1回の投与量は胃容量を考慮し、10〜20 ml/kg程度を目安としますが、初回は少量から開始し、徐々に増量し、1日4〜6回に分けて投与します。
リフィーディング症候群(Refeeding Syndrome)
長期間絶食していたウサギに対して急激に高カロリーの給餌を行うと、リフィーディング症候群を発症し、致死的な結果を招く恐れがあります。 急激なグルコース流入によりインスリンが分泌され、血中のリン、カリウム、マグネシウムが細胞内に取り込まれる。これにより重篤な低リン血症などが生じ、溶血、筋力低下、呼吸不全、不整脈を引き起こします。予防策として、給餌開始初日はRERの25〜50%程度に留め、3〜5日かけて目標カロリーに到達させる漸増法をとります。低炭水化物・高繊維質の食事を選択します。可能な限り血清電解質(特にリン、カリウム)をモニタリングし、必要に応じて補正を行います。
輸液療法
脱水は消化管内容物を乾燥させ、うっ滞を悪化させるだけでなく、肝臓への血流を低下させ解毒機能を阻害します。乳酸リンゲル液などの晶質液が基本となりますが、ショック状態ではコロイド液の併用も考慮されます。ウサギの維持輸液量は 100~120mL/kg/日と高く設定され、これに脱水補正量を加えて投与します。血糖値を確認した上で、低血糖がある場合やケトーシス改善のために、2.5〜5%のブドウ糖を添加した輸液を行うことがあります。ただし、高血糖時にはブドウ糖を含まない輸液を選択し、リフィーディング症候群のリスクも考慮します。
薬物療法
肝リピドーシスを発生した基礎疾患に対して治療し、肝臓にも肝保護薬ならびに抗酸化剤を投与します。
| 薬剤分類 | 薬剤 | 投与量 | 備考 |
| 消化管運動改善薬 (Prokinetics) | メトクロプラミド (Metoclopramide) | 0.5 mg/kg, PO/SC/IV, q6-12h | 主に胃および小腸上部の運動を促進する。ドーパミン拮抗作用。閉塞時は禁忌。 |
| シサプリド (Cisapride) | 0.5 mg/kg, PO, q8-12h | 食道、胃、小腸、結腸全体の運動を促進する。セロトニン受容体作動薬。入手困難な場合があるが、下部消化管のうっ滞に効果的とされる。 | |
| ラニチジン (Ranitidine) | 2-5 mg/kg, PO/SC/IV, q12h | H2受容体拮抗薬だが、アセチルコリンエステラーゼ阻害作用による消化管運動促進効果も期待される。 | |
| 鎮痛剤 (Analgesia) | ブプレノルフィン (Buprenorphine) | 0.01-0.05 mg/kg, SC/IV, q6-8h | オピオイド系鎮痛薬。内臓痛に効果的であり、消化管運動への抑制作用は比較的少ないとされる。 |
| メロキシカム (Meloxicam) | 0.3-1.0 mg/kg, SC/PO, q24h | NSAIDs。抗炎症・鎮痛作用。腎機能低下や重度脱水時は慎重投与。 | |
| 肝保護薬・抗酸化剤 | シリマリン (Silymarin / Milk Thistle) | 6.5-13 mg/kg, PO | 抗酸化作用、肝細胞膜安定化作用。ウサギの成長率改善や肝酵素抑制効果が報告されている。 |
| S-アデノシルメチオニン (SAMe) | 犬猫用量を外挿 | グルタチオン前駆体として抗酸化作用を発揮。肝障害時の支持療法として使用される。 |
予後と転帰
ウサギの肝リピドーシスの予後は、介入のタイミング、基礎疾患の種類、および合併症の有無に大きく依存します。早期(発症から24時間以内など)に診断され、適切な輸液と強制給餌が開始された単純な消化管うっ滞に伴うリピドーシスであれば、多くの症例が回復します。予後不良なケースは重篤で、進行した病態を指し、入院時の低体温(<36.6℃)、重度の貧血、高血糖または低血糖、高脂血症(高コレステロール血症)は、死亡リスクを高める有意な因子となります。ケトアシドーシス、肝性脳症、胃穿孔、腹膜炎を併発している場合、予後は警戒から不良、あるいは極めて不良となります。
まとめ
ウサギの肝リピドーシスは、被食者としての進化の過程で獲得した高い代謝率と、特異な脂質代謝機構(VLDL分泌の限界と肝性リパーゼ欠損)という生理学的背景の上に成り立つ、極めて進行の早い代謝性疾患です。いくつかの検査で診断を下し、的確な治療を施しましょう。
参考文献
- Chang S,Borensztajn J.Hepatic lipase function and the accumulation of beta-very-low-density lipoproteins in the plasma of cholesterol-fed rabbits.Biochem J293(Pt 3):745-750.1993
- Donnelly T. Basic Anatomy, Physiology, and Husbandry. In Ferrets, Rabbits, and Rodents.Hillyer E,Quesenberry K eds.WB Saunders. Philadelphia:p147-159.1997
- DeCubellis J,Graham J.Gastrointestinal Disease in Guinea Pigs and Rabbits.Vet Clin North Am Exot Anim Pract16(2):421-435.2013
- Jenkins J.Rabbit and Ferret Liver and Gastrointestinal Testing. In Laboratory Medicine:Avian and Exotic Pets.Fudge A ed.WB Saunders.Philadelphia:p291-304.2000
- Kawata R et al.Quantitative Evaluation of Fatty Liver by Computed Tomography in Ranbbits.AJR.1984
- Ozawa SM et al.Clinicopathological findings in and prognostic factors for domestic rabbits with liver lobe torsion: 82 cases (2010-2020) J Am Vet Med Assoc260(11):1334-1342.2022
- Melillo A.Rabbit Clinical Pathology.J Exot Pet Med16(3):135-145.2007
- Meredith AL,Rayment L.Liver disease in rabbits.Seminars in Avian and Exotic Pet Medicine9(3):146-152.2000
- Nutritional Guidelines For Feeding Pet Rabbits.https://europeanpetfood.org/wp-content/uploads/2024/11/FEDIAF-Nutritional-Guidelines-for-Feeding-Pet-Rabbits_NEW.pdf
- Reusch B.Reusch B.Rabbit Gastroenterology.Vet Clin North Am Exot Anim Pract8(2):351-375.2005
- Veenstra JW,Filgo AJ,Denham SC.Effect of Feeding Hay on Nonesterified Fatty Acids in Appetite-suppressed Pregnant New Zealand White Rabbits.Comp Med;70(1):35-44.2020
- Varga M.Clinical Pathology.Textbook of Rabbit Medicine:111-136. 2013
- Zhang X,Chinkes DL,Aarsland A,Herndon DN,Wolfe RR.Lipid metabolism in diet-induced obese rabbits is similar to that of obese humans.J Nutr138(3):515-8.2008