背景
爬虫類における投薬は、種類毎に対応が異なります。カメは身体を甲羅で覆われ、四肢や首を収納させて防御姿勢をとり、投薬も首を引っ込めてしまうと何もできなくなります。細長い体をもったヘビは、四肢も欠いており、投薬の想像がつかないかもしれません。それに比べてトカゲやカメレオンは犬や猫の投薬手段に近いかもしれません。そして、外気温動物であるため、投薬された薬剤が身体の代謝の影響を受けることを年頭におかなければなりません。
外気温動物
外温動物である爬虫類は、温度変化が薬物の分布、代謝、排泄、ひいては消失半減期に大きな影響を与えます。一部の治療法では、治療中に爬虫類を一定温度に保つよう指示しています。例えば、体温が高いほど薬の吸収が早くなる場合や、逆に代謝が活発になり薬の効果が弱まる場合があります。体温が下がると、薬剤の排泄が遅れ、薬の副作用が出やすくなる場合もあります〔Varga 2004〕。変温動物は寒くなると冬眠に入り、代謝を極端に低下させます。この状態では、薬の効果がほとんど発揮されない可能性があります。
腎門脈
爬虫類は腎門脈が発達しており、体の尾側からの血液は腎臓を通過して心臓に到達します。理論的には、身体の後部への注射は薬剤が直接腎臓に流れ込むため、薬剤がより早く排泄されたり、腎毒性が起こる可能性があります。しかし、研究では血管に弁が備わっており、必ずしも腎臓に流れ込むとは限らないという考えも出てきています。しかしながら、薬剤への影響は未だ解明されていないため、暫定的に前肢の筋肉、 および付け根の皮下が一般的な注射部位とされています。
薬剤投与
投与は経口投与と非経口投与に分けて行われます。
経口投与
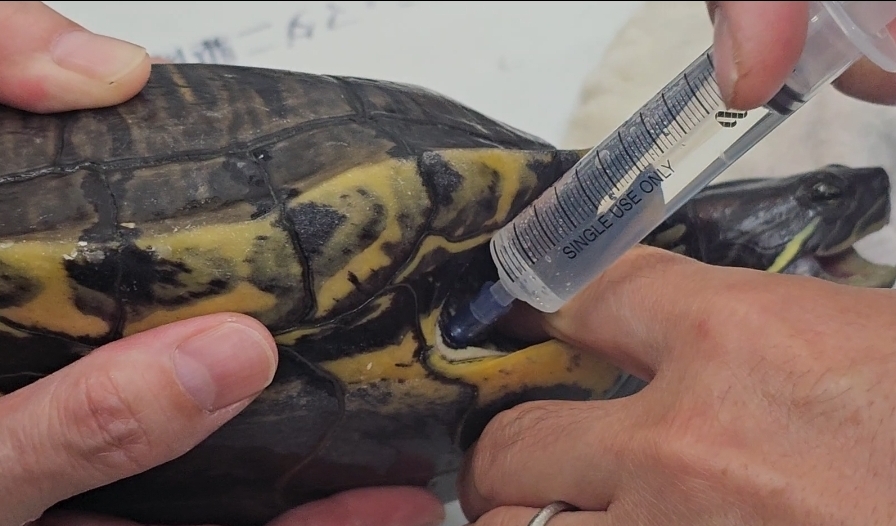
全般的な爬虫類、特にカメは防御姿勢で容易に首を甲羅内に引っ込めてしまうために、経口投与が難しいとされています。粉薬を溶かしたり、液薬をスポイトを使用して直接口の中へ滴下して飲ませます。動物をタオルなどで包みこんで、頭だけを抑えて、口の端にスポイトやシリンジ、ゾンデを挿入して、薬液を強制的に注入します。小型~中型のカメでは、鼓膜の尾側あたりを掴んで、伸展した状態を保ちますが、多くは抵抗されます。下顎と上顎に一定の牽引力を加えることで開口させますが、トカゲでは、デュラップをゆっくりと牽引して開けます。しかし、力強い個体や大型の種類では力任せで頸を進展させたり、開口することはできませんし、咬みついてくることもあり、鎮静剤や麻酔か使用されます。
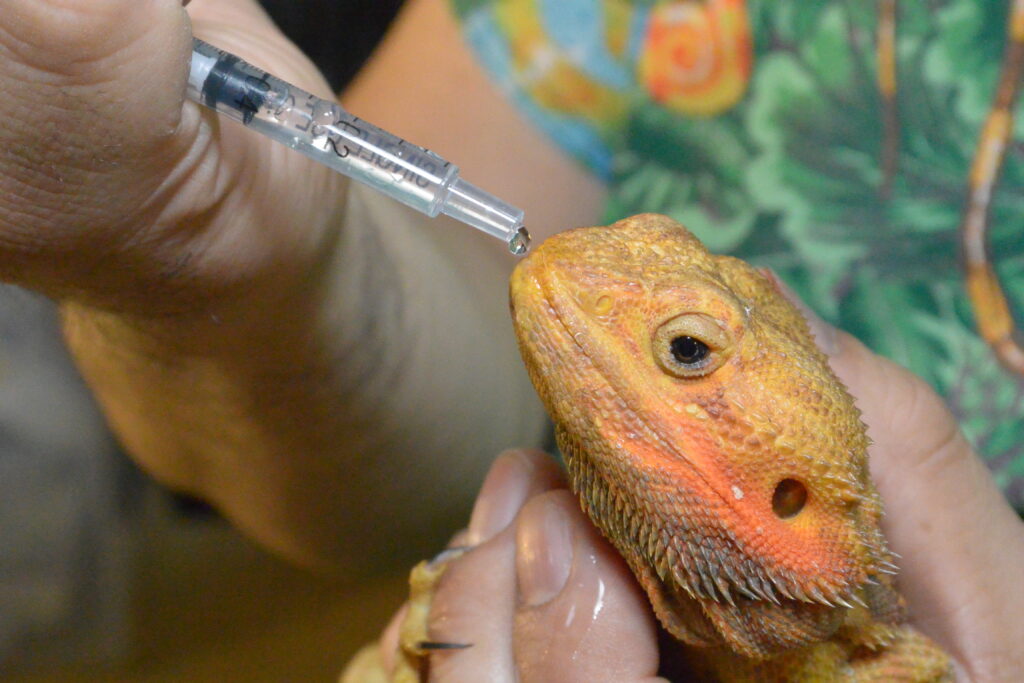
混餌投与
混餌投与とは餌に添加して食べさせて投与するという方法になります。餌に薬を混ぜる方法は、通常の食餌の一部として薬を摂取する自然な方法で、陸ガメやトカゲなどでは餌に粉のサプリメントを振りかけていることが多く、あまり抵抗がないはずです。混餌投与は比較的ストレスを感じず、容易に行えます。特に爬虫類が好んで食べる食材を選び、粉や液剤を選んだ食材に添加させたり、混ぜて与えます。薬を動物に察知されないようにすることがポイントとなり、少量ずつ食材を与え、薬を確実に摂取させます。動物によっては、薬の匂い、味、色を敏感に察知して食べない場合もあります。その場合は、薬の匂いや色を隠すために、工夫が必要となります。 なお、カメやトカゲがゼリー状やペースト状の食べ物を好む場合、混餌投与は有効です。カメにも使えるゼリーやペーストが市販されており、これを利用してみるのは得策です。

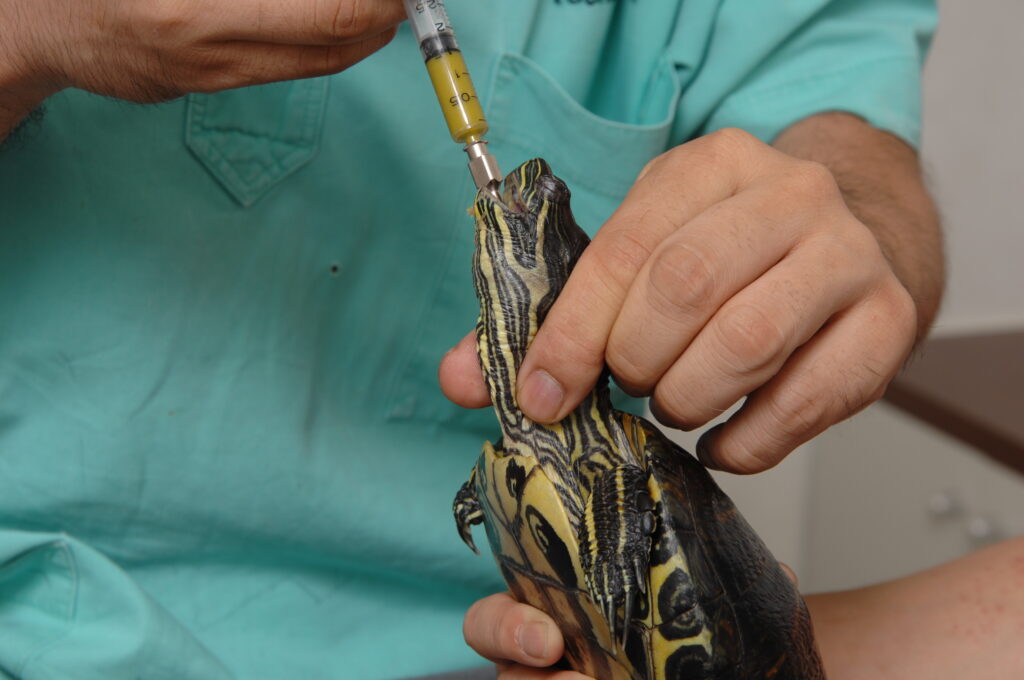
経口チューブ
管を挿入して投薬する胃チューブによる方法は、大量の薬剤や水分、餌を与える際に使用されます。金属製のゾンデやゴム製の柔軟な胃管が使用されます。爬虫類は声門が前方に位置し、開いているよりも閉じていることが多いため、チューブを胃に挿入するのが比較的容易です。チューブは空気を過剰に注入しないように液体をあらかじめ充填しておく必要があります。チューブを硬口蓋に沿って背側に通します。大型のヘビ、トカゲ、そしてすべてのカメ類は、チューブを噛んで飼育者に噛み付かないように、口靴が必要になります。ヘビでは管を頭側3分の1(胃の位置)に挿入します。噴門括約筋が弱いために逆流が起こりやすく、挿入中および挿入後2分間はヘビを垂直に保ちます。最大投与量は15~30mL/kgになります〔Rees Davies et al.2004〕。トカゲはサイズに応じて経鼻胃管または古い点滴チューブなどを使用します。尾肋骨のすぐ後ろの胃の位置まで挿入し、最大投与量は10~20mL/kgになります〔Rees Davies et al.2004〕。カメの胃は腹甲の左中央に位置しています。多くのカメ類では頭部を伸ばすのが難しく、時間と忍耐が必要となります。頭部は甲羅から完全に伸ばさなければならず、そうでないと逆流します。最大量は5~15mL/kgになります〔Rees Davies et al.2004〕。
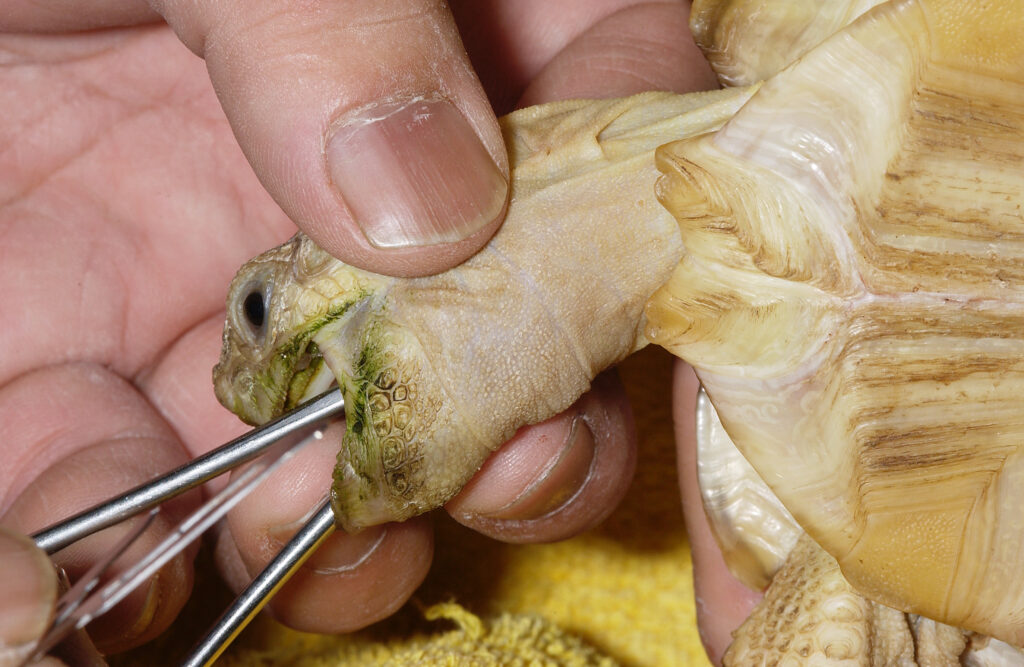
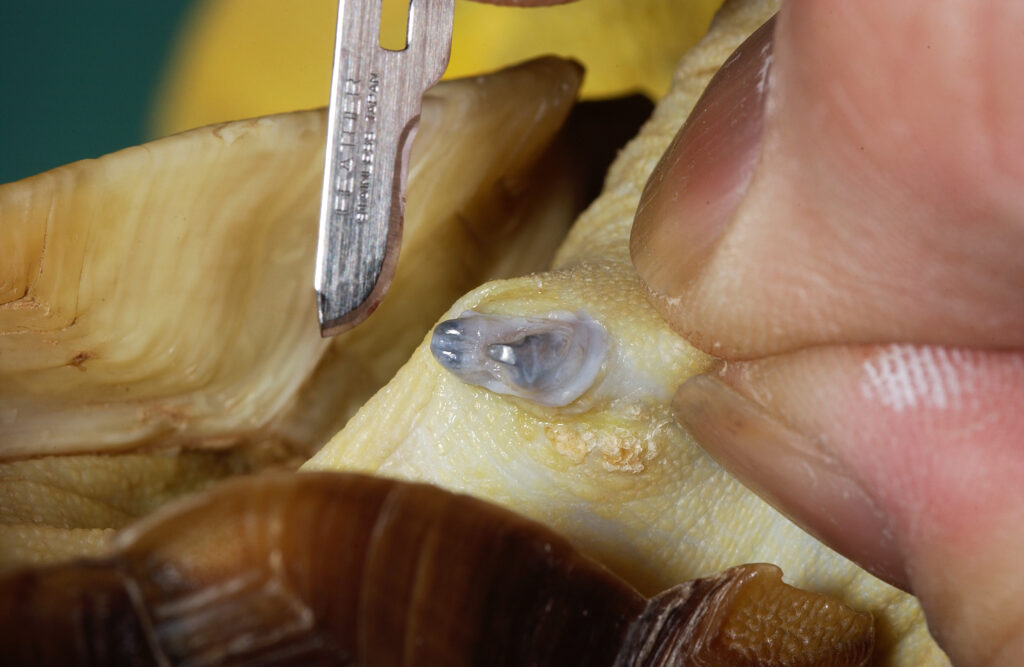
食道瘻チューブ
胃チューブは、水分や食物(経腸栄養)、薬剤を上部消化管へ送り込むことを可能にします。しかし、カメでは首や首に過度の拘束を行う必要もあり、多くは防御姿勢で頭を出すことさえもでできません。 そこで、特に体力がある、あるいは臆病なカメ、また反復の投与がが必要となる場合、食道瘻チューブの設置は実用面と動物福祉の両面で有益な方法となります〔Jimenez et al.2007〕。衰弱した動物では、通常は用手拘束と局所麻酔で設置できますが、一般的には短期間の軽麻酔が必要となります。チューブはジャックソン猫カテーテル、犬尿道カテーテル、または鼻胃供給チューブなどを選択し、予め胃までの長さに切断します。チューブを首に装着する部位の長さの半分に印をつけます。湾曲した止血鉗子を口から入れ、食道の側面に沿って、首の奥までテント状に固定します。皮膚に止血鉗子の上から刺し傷を入れ、止血鉗子の先端部分が見えるようにします。次に、柔らかいゴム製の栄養カテーテルをつかみ、切開部から口から引き抜きます。次に、栄養チューブを食道に沿って下ろし、胃にまで挿入します。チューブの印の部分できるだけチューブの首からの出口付近にテープ状の蝶形縫合テープを巻き付け、首に縫合します。半水生種の場合、縫合部位にチューブを固定するには、組織接着剤を使用することをお勧めします。チューブの先端を背甲にも取り付けます。カテーテルからの薬剤、水分や餌を投与した後のフラッシングとチューブ挿入部位の毎日の洗浄を行えば、これらのチューブは何週間も安全に使用でき、水ガメにおいても可能です。



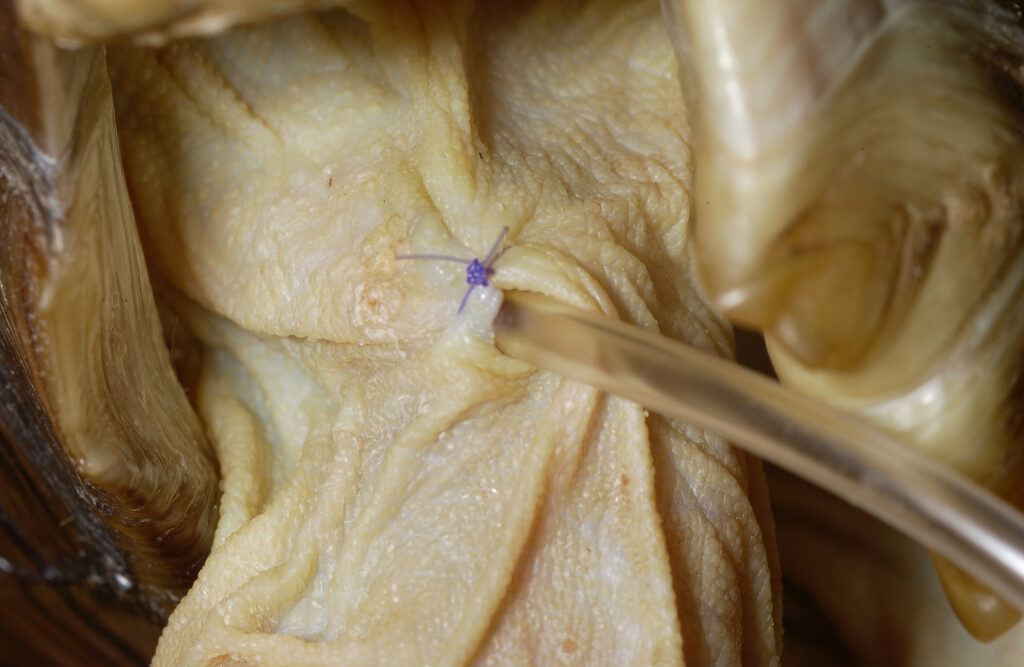

非経口投与
非経口投与は、筋肉内、皮下、静脈内、体腔内、また骨髄内に投与します。
筋肉内投与(注射)
筋肉内注射は皮下注射よりも吸収が速いため、速やかな吸収が求められる薬物に最適です。薬物動態がより安定し信頼性が高いため、最適とされており、迅速かつ確実な吸収となり、多くの薬剤の推奨投与経路です。筋肉内投与は静脈投与と比べて半減期も滞留時間も必然的に長くなる〔Corum et al.2019〕、または大きな相違はないという報告〔Stampe et al.1999〕もあります。大型のカメであれば筋肉内注射は問題ありませんが、小型のカメの場合、小さな筋肉に大量の薬物を注射すると神経損傷のリスクがあります〔Villarejo 1993〕。カメの場合は前肢の筋肉に注射するのが一般的です。
皮下投与(注射)
爬虫類は皮下の空間が乏しく、大量の薬液を入れにくいため、分割して行うことがあります。皮膚ならびに鱗に穿刺した箇所から、薬液が漏れることがあり、少量にするか、よく揉んで拡散しておくべきです。皮下投与は薬剤がの吸収が遅く、薬効の信頼性も低いですが、犬や猫のように投与する手技が容易なため、頻繁におされます。


静脈投与(注射)
爬虫類への静脈穿刺は容易ではなく、局所麻酔または全身麻酔下での切開手術が必要となる場合が多いです。カメでは頸静脈、トカゲでは尾静脈へのアクセスが容易かもしれません。
体腔内投与(体腔内注射)
トカゲの体腔内投与は左右の下腹部に穿刺します。ここには、脂肪が付着している領域なため、内臓を穿刺する可能性が低いです。しかしながら、痩削した個体では、脂肪が少ないために、注意しなければなりません。

カメの体腔内注射は、橋と肢の間に穿刺して行います。 後肢と橋の間からの前大腿窩には膀胱があるため、超音波装置で確認をしてから行わないと刺してしまいます。
体腔ならびに腹腔からの薬物吸収は表面積が大きいため非常に速いのが特徴で、大量に注入できることも利点です。一般的には輸液療法や緊急時の薬剤投与に適しています。筋性の横隔膜が欠如しているため、体腔内液が多量になると理論的には肺機能が損なわれる可能性があるとされていますが、実際にはそのようなことは極めて稀です。
骨髄内投与(骨髄内注射)
骨髄内投与は、静脈投与よりも簡単な救命救急技術で、トカゲとカメで使用できます。一般的には、骨髄針(または非常に小型の種の場合は25g前後の注射針)を大腿骨遠位部あるいは脛骨近位部から挿入します。四肢を屈曲させ、大腿骨あるいは脛骨結節の位置を特定して可能な限りに無菌的な操作で、針を髄腔に向けます。骨髄の吸引され、ヘパリン化生理食塩水でのフラッシュに対する抵抗の低さ、またはX線撮影によって、正しい位置を確認します。代謝骨疾患を患っている個体では、四肢骨折が潜在的な合併症であるため、細心の注意を払う必要があります。大型の陸ガメでは、腹甲骨橋の髄腔に挿入できます。
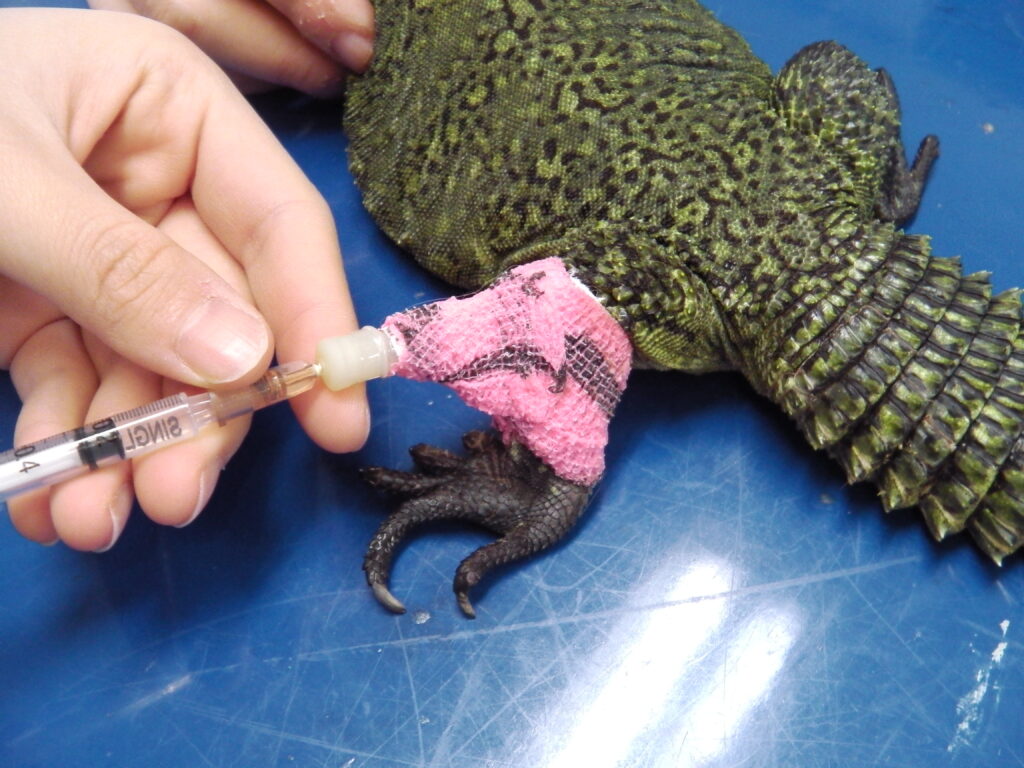
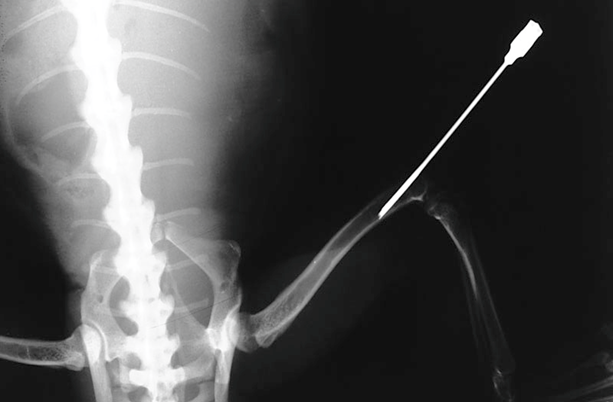
輸液療法
爬虫類における輸液は、脱水、食欲不振、外科手術、衰弱といった様々な状況で極めて重要な治療法です。しかし、その代謝率や生理機能は哺乳類と大きく異なるため、投与する輸液の量や速度は慎重に決定する必要があります。
脱水の評価
輸液を開始する前に、まず脱水の程度を評価することが不可欠です。脱水率は体重減少率を基に推定するのが最も客観的ですが、過去の正確な体重が不明な場合も多いため、身体検査所見が重要な指標となります。
脱水率の目安
- 5%未満(軽度): 症状はほとんど見られないか、ごくわずかで、乾燥による口腔粘膜にやや粘着性が見られることがあります。
- 5-10%(中等度):眼球の陥没(Sunken eyes)、皮膚の弾力性低下(爬虫類ではわかりにくい)、口腔粘膜の乾燥と高い粘着性が見られ、唾液は粘稠で糸を引くようになります。
- 10-15%(重度):上記の症状が顕著になり、極度の衰弱や意識レベルの低下が見られます。ショック状態に陥る危険性が高い状態です。
爬虫類の皮膚は弾力性がないため、皮膚ツルゴール(皮膚をつまんで元の状態に戻るまでの時間)の評価は哺乳類ほど信頼性が高くないです〔O’Malley 2011,Sykes 2020〕。そのため、尿量の減少や鱗の硬結など複数の所見を総合的に評価することが重要なのですが、その評価は熟練していないと難しく、主観的に偏ります。重度の脱水は、高尿酸血症、腎機能障害、電解質異常を引き起こし、生命を脅かすため、迅速かつ適切な輸液療法が不可欠となります。

総輸液量の計算
1日に投与すべき総輸液量は、以下の3つの要素を合計して算出します。
総輸液量 (mL/day)=維持輸液量+脱水補正量+継続的な損失量
維持輸液量 (Maintenance Rate)
生命活動の維持に最低限必要な水分量です。爬虫類の維持輸液量は、一般的に10~30 mL/kg/dayとされています 〔O’Malley 2011〕。この範囲は種や活動レベル、環境温度によって変動します。
脱水補正量 (Deficit Volume)
失われた水分を補うための量で、以下の式で計算されます。
脱水補正量 (mL)=体重 (g)×脱水率 (%)
例えば、体重500gで8%の脱水が見られるトカゲの場合、脱水補正は500g × 0.08 = 40mLとなります。
損失量 (Ongoing Losses)
嘔吐、下痢、多尿、傷口からの浸出液などがある場合に、その量を推定して加算します。
輸液速度と投与計画
爬虫類の輸液における最も重要な原則の一つは、急激な水分投与を避け、時間をかけて補正することです。腎機能や代謝が哺乳類よりも遅いため、急速な輸液は肺水腫や体液区画の急激な変化を引き起こす危険性があります〔O’Malley 2011〕。
一般的な脱水補正
脱水補正は、通常 24時間から72時間 かけて行います〔O’Malley 2011〕。 一般的な投与計画としては、以下のような方法が挙げられます。
- 計画例:
- 1日目: 維持輸液量 + 脱水補正量の50%
- 2日目: 維持輸液量 + 残りの脱水補正量の50%(全体の25%)
- 3日目: 維持輸液量 + 残りの脱水補正量(全体の25%)
この計画に基づき、1日の総輸液量を計算できます。静脈からの輸液の場合は、それを24時間で割ることで、1時間あたりの投与速度(mL/hr)を算出できます。

ショック状態の治療
循環不全を伴う重度の脱水(ショック状態)の場合、生命を維持するために初期に迅速な輸液(ボーラス投与)が必要となることがあります。しかし、爬虫類は哺乳類と異なり、心臓内に右左シャントが存在するため、急激な静脈内投与が循環動態に予期せぬ影響を与える可能性があります〔O’Malley 2011〕 。したがって、爬虫類に特化したショック時のボーラス投与量に関する明確なコンセンサスは確立していませんが、一部の文献では、より慎重なアプローチが推奨されています。哺乳類や鳥類で用いられる急速輸液プロトコルをそのまま適用するのではなく、獣医師が心拍数や血圧などのバイタルサインを厳密にモニタリングしながら、5~15 mL/kg 程度の晶質液を15~60分かけて投与し、その反応を評価します。ショック状態が離脱した後は、上記の一般的な脱水補正計画に移行します。
膠質液の効果
膠質液は、アルブミンやヘタスターチなど、毛細血管壁を通過しにくい高分子物質を含み、血漿膠質浸透圧を維持・上昇させることで血管内水分量を効果的に増加させます。重度の低アルブミン血症や、ショック状態における循環血液量の迅速な回復を目的として使用されます〔Muir 2009〕。しかし、爬虫類における膠質液の薬物動態や安全性に関するデータは乏しく、過剰投与は急性腎障害や凝固異常のリスクを伴う可能性があるため、その使用は緊急時や重症例に限定し、晶質液と併用するのが一般的です。
輸液経路の選択
水分補給の方法中度から重度の脱水症状輸液は静脈内、骨内、または体腔内投与が可能です。脱水の重症度や動物の状態に応じて適切な投与経路を選択します。
- 経口 (PO): 軽度の脱水で、消化管機能が正常な場合に適用になります。
- 皮下 (SC): 軽度から中等度の脱水に対応できます。脱水症状ね爬虫類の皮膚は弾力性に乏しく、重度の衰弱状態にあると水分吸収が悪くなり、吸収速度は比較的緩やかになります。
- 腹腔内 (ICo): 中等度の脱水に用いられ、吸収は皮下より速いです〔O’Malley 2011〕。体腔内投与はアクセスが容易ですが、爬虫類には横隔膜がないため、過負荷で呼吸を妨げないよう注意が必要し〔O’Malley 2011〕、1回の投与量は体重の2-3%を超えないように注意します。
- 静脈内 (IV) / 骨髄内 (IO): 中等度から重度の脱水、特にショック状態の際に最も効果的な経路になります〔O’Malley 2011〕。迅速な効果が期待できますが、カテーテル留置には技術を要します(DVM360)。静脈内投与では大型ヘビの頸静脈を切開する必要がある場合がありますが、トカゲ類では尾静脈が有用です。虚脱している爬虫類や小型爬虫類では、骨内投与が唯一の投与経路となる場合が多くあります〔O’Malley 2011〕。
輸液剤の種類
爬虫類の輸液は、現在のエビデンスに基づけば、乳酸リンゲル液や酢酸リンゲル液のような等張性の平衡塩類溶液が、多くの症例において第一選択となります。これらの輸液は、細胞外液の組成に近く、生理的なpHの維持に貢献します。かつて推奨された低張の爬虫類リンゲル液の使用は、電解質異常を引き起こすリスクから、現在では慎重であるべきとされています〔Sismour et al.2020〕。
- 乳酸リンゲル液(Lactated Ringer’s Solution, LRS): 生理食塩水にカリウム、カルシウム、乳酸ナトリウムを加えたもので、組成が細胞外液に近く、等張性であるため、最も一般的に使用される輸液の一つである〔Eatwell 2011〕。特に、代謝性アシドーシスを伴う脱水症例において、乳酸が肝臓で重炭酸イオンに変換されることで緩衝作用が期待できます。ただし、重度の肝機能障害を持つ個体では乳酸の代謝が遅れる可能性があるため注意が必要です。実験的に脱水させたフトアゴヒゲトカゲにおいて、乳酸リンゲル液の皮下投与が有効であったことが示されています〔Sismour et al.2020,Parkinson et al.2020〕。
- 酢酸リンゲル液やグルコン酸リンゲル液: 乳酸の代わりに酢酸やグルコン酸を含む等張性晶質液も有用な選択肢である。これらの緩衝前駆物質は肝臓だけでなく筋肉でも代謝されるため、肝機能が低下している可能性のある症例でも比較的安全に使用できるとされています〔Sismour et al., 2020〕。
- 生理食塩水(0.9% NaCl): ナトリウムとクロールのみを含む等張液であり、高カリウム血症や高カルシウム血症の症例、あるいは低クロール性代謝性アルカローシスの治療に適しています〔DiGiacomo 2017〕。しかし、カリウムや緩衝物質を含まないため、長期的な維持輸液には不向きです。
- 低張液(例:爬虫類リンゲル液): 伝統的に、5%ブドウ糖溶液と等張性晶質液(生理食塩水)を1:1で混合した低張の「爬虫類リンゲル液(Reptile Ringer’s Solution, RRS)」が推奨されることがありました〔Prezant et al.1997〕。これは、爬虫類の血漿浸透圧が哺乳類よりも低いという考えに基づいていました〔Wilkinson 2004〕。しかし、近年の研究では、この種の低張液の投与が医原性の低ナトリウム血症や高血糖を引き起こす可能性が指摘されており、特にフトアゴヒゲトカゲにおいては推奨されないことが示唆されています〔Sismour et al.2020,Parkinson et al.2020〕。
爬虫類用リンゲル液の支持された理由
乳酸リンゲル液は実際には病気の爬虫類の回復に有害である可能性があると考えられ、さらに等張液ゆりも低張液が理想とされ、5%ブドウ糖水溶液と非乳酸等張液(生理食塩水)の50/50配合を推奨されてきました。
乳酸を避ける理由
爬虫類は様々な状況下で嫌気性代謝を利用し〔Bennet 1982,Gotten et al.1991,Gotten 1985,Pough et al.1985,〕、その結果、乳酸を体内に蓄積します。嫌気性代謝は好気性代謝に比べてATP生成効率が低く、グリコーゲンを乳酸に変換します。多くの研究により、健康な爬虫類は様々な身体的・生理的運動を行った後に比較的多量の乳酸を蓄積することが実証されていますが、通常の移動、潜水、交尾といった日常的な活動は一般的に好気性活動の範囲内で行われ、したがって大量の乳酸蓄積にはつながらないことが実証されています〔Bennet 1982,Pough et al.1985〕。様々な行動様式をとることで乳酸負荷を軽減することができますが、治療のために来院する多くの病気の爬虫類は、かなりの乳酸負荷を蓄積していると著者らは考えられ、病気、不適切な飼育、そして治療のための拘束捕獲や輸送中、そして拘束とサンプル採取を伴う検査中にもによるストレス、冬眠などは、大量の乳酸の代謝蓄積に寄与します〔Bennet 1982〕。この体全体の水分量のうち、細胞内液量が哺乳類よりも比較的多く、細胞外液量(その大部分は血漿)は、一般的にほとんどの哺乳類よりも少ないです〔Thorson 1968〕。爬虫類の血漿浸透圧は、ほとんどの哺乳類と同等かそれ以上です〔Cooper et al. 1981,Pough et al.1985〕。これらの乳酸負荷は、多くの生理機能に支障をきたし、乳酸濃度が高い爬虫類は生理的に疲労し、刺激に適切に反応できなくなります。しかし、グリーンイグアナに関するある研究では、活動中のイグアナのエネルギーの3分の2以上が嫌気性生活に由来することが実証され〔Moberly 1968
低張液が良い理由
爬虫類では、哺乳類と同様に、細胞外液区画(ECF)と細胞内液区画(ICF)の2つの主要な体液区画があります。爬虫類では、哺乳類と同様に、これら2つの区画の電解質組成は大きく異なり、細胞外液はナトリウムが非常に多く、カリウムが非常に少なく、細胞内液ではその逆です。しかし、哺乳類とは対照的に、爬虫類は体全体の水分量が約65~75%を占め、比較的多い特徴かあります〔Thorson 1968,Mader 2006〕。この体全体の水分量のうち、細胞内液量が哺乳類よりも比較的多く、細胞外液量(その大部分は血漿)は、一般的にほとんどの哺乳類よりも少ないです〔Thorson 1968〕。爬虫類の血漿浸透圧は、ほとんどの哺乳類と同等かそれ以上です〔Cooper et al.1981,Frye 1981〕。爬虫類の血漿量は比較的少なく、細胞内液量が多いことを考慮すると、脱水した爬虫類では、細胞内液量の回復は循環血漿量の回復と少なくとも同等に重要です。爬虫類に最もよく見られる脱水症状の形態を考えると、軽度の低張液の使用も適切であり、等張液よりも有益です。一般的に、脱水には3つの形態があります。1) 等張性脱水(一般的に出血、重度の組織損傷、嘔吐、下痢、または食欲不振を伴う)、2) 低張性脱水(一般的に長期の食欲不振に起因する)、 3) 高張性脱水症。これは通常、不感蒸泄または飲水拒否10によって引き起こされます。爬虫類患者の脱水症状の形態は、病歴、臨床徴候、および診断に基づいて臨床医が評価する必要があります。著者らの経験では、爬虫類患者ではある程度の水分喪失が一般的です。したがって、軽度の低張液の投与は、等張液よりも細胞内および全身の水分貯蔵量をより迅速に補充します。
噴霧療法(ネブライザー療法/エアロゾル療法)
爬虫類の噴霧療法(ネブライザー療法)は、特に呼吸器系の疾患に対する効果的な治療法の一つです。薬液を霧状にして吸入させることで、薬剤を直接患部の気管や肺に届け、全身への副作用を抑えながら高い治療効果が期待できます。霧状の薬剤で満たしたプラケースや衣装ケースなどの容器に爬虫類を入れ、10〜20分程度吸引させます。治療の頻度や期間は、症状や原因、使用する薬剤によって大きく異なります。薬剤は哺乳類と同様に、抗生物質(アミカシン5mg/L〔Schumache 2003〕など)や抗真菌薬、ステロイド剤などを生理食塩水に溶解した薬液を使用します。 しかし、気管支拡張薬や粘液溶解剤を投与することも可能ですが、爬虫類におけるこれらの薬剤の有効性に関するデータは不足しています。気管支拡張薬の投与は、心血管系への副作用の可能性があるため、慎重に行う必要があります〔Malik et al.1972〕。

外用薬
爬虫類の皮膚は、厚いβケラチン層からなる鱗で覆われており、体内の水分蒸発を防ぐための強力なバリアとして機能しています〔Jacobson 2007〕。この乾燥した角質層は、水溶性および脂溶性の多くの薬剤の経皮吸収を著しく妨げる要因となります〔Scott et al.2001〕。そのため、外用薬の有効成分が標的部位へ到達するためには、皮膚の完全性が損なわれている創傷部や感染部位への適用がより効果的となります。
消毒薬
ポビドンヨード: 広範な抗菌スペクトルを持つが、細胞毒性も示し創傷治癒を遅延させる可能性が指摘されています〔Mader 2006〕。使用する場合は、10%原液を茶褐色になるまで希釈(0.1-1%)することが推奨されています。また、甲状腺機能への影響も考慮し、長期・広範囲の使用は避けるべきです〔Jacobson 2007〕。
クロルヘキシジン: ポビドンヨードと比較して細胞毒性が低く、残存効果があるため、創傷や皮膚炎の消毒に広く用いられます〔Antinoff et al.2012〕。
抗菌薬
スルファジアジン銀 (SSD): 広域スペクトルを持ち、特に熱傷や細菌に汚染された重度の創傷に対して有効です〔Mader 2006〕。特に緑膿菌(Pseudomonas aeruginosa)に対して強い抗菌活性を示しますが、創傷治癒を遅らせる可能性も報告されています〔Antinoff et al. 2012〕。
抗真菌薬
アゾール系抗真菌薬(ミコナゾール、クロトリマゾール): クリームやローションとして局所的に使用され、皮膚糸状菌や酵母様真菌に対して有効です〔Jacobson 2007〕。全身投与と併用されることも多いです。
駆虫薬
フィプロニル: スプレー剤として使用されることがあります、カメに対しては極めて強い神経毒性を示し、致死的であることが広く知られています〔Barten 2006〕。リクガメやハコガメでの死亡例が多数報告されており、絶対は禁忌になります。
イベルメクチン: フィプロニルと同様に、カメ類に対しては血液脳関門を容易に通過し、重篤な中枢神経症状を引き起こすため禁忌です〔Mader 2006〕。トカゲやヘビでも過剰投与による中毒死のリスクがあるために注意するべきです。
待望の新刊! 爬虫類の病気百科
エキゾチックアニマル臨床の第一人者 霍野晋吉が贈る、獣医師そして飼育者、ブリーダーまで、全爬虫類関係者へ送る医学バイブル
引用文献
- Antinoff N,Carpenter JW.Exotic Animal Formulary 4th ed.Elsevier Saunders.2012
- Barten SL.Lizards.In Reptile Medicine and Surgery 2nd.Mader DR ed.Saunders Elsevier:p59-90.2006
- Bennet AF.The energetics of reptilian activity,In Biology of the Reptilia. Vol. 13.Gems, C., Pough, F.H. (eds): london, UK, Academic:p155-199.1982
- Boyer TH.Emergency care of reptiles.Veterinary Clinics of North America: Small Animal Practice26(6):1355-1367.1996
- Chew DJ.Fluid Therapy in Dogs and Cats In Small Animal Practice.Birchard SJ,Sherding RG eds.WB Saunders, Philadelphia.PA:p64-76.1994
- Corum O et al.Pharmacokinetics of intravenous and intramuscular danofloxacin in red-eared slider turtles (Trachemys scripta elegans).Journal of Veterinary Medical Science81(5):753-757.2019
- Cooper JE,Jackson OF eds.Diseases of Reptilia2.Academic.San Diego.CA:p507-534.1981
- DiGiacomo R.Reptile and Amphibian Medicine and Surgery.In Kirk’s Current Veterinary Therapy XVI.Bonagura KR,Twedt DC.edsElsevier:p1183-1191.2017
- Divers SJ.Reptilian renal disease. Veterinary Clinics of North America: Exotic Animal Practice8(3):517-539.2005
- Divers SJ,Mader DR.Reptile Medicine and Surgery 2nd.Saunders.2005
- Frye Fl.Fungal,actinomycete,Bacterial,Rickettsial,and Viral Disease.In Biomedical and Surgical Aspects of Captive Reptile Husbandry, 2nd Vol1. frye Fl ed.Krieger Publishing Co.Melbourne.Flo.1991
- Frye Fl.Biomedical and Surgical Aspects of Captive Reptile Husbandry.Veterinary Medicine PUblishing Co.Edwardsville.KS.1981
- Gotten RR,Congdon JD,Mazzotti FJ,Fischer RV.Glycolysis and Swimming Performance in Juvenile American Alligators.Journal of Herpetology25(4):406-411.1991
- Gotten RR.The use of anaerobiosis by amphibians and reptiles.Am Zool25:945-954.1985
- Jacobson ER.Infectious Diseases and Pathology of Reptiles:Color Atlas and Text.CRC Press.2007
- Jimene M,Divers H.Emergency care of reptiles.Vet Clin Exot Anim10:557-585.2007
- JMuir WW.Crystalloids and colloids.In Handbook of Veterinary Anesthesia 4th ed.Mosby Elsevier:p496-513.2009
- Klingenberg RJ.Therapeutics In Reptile Medicine and Surgery.Mader DR ed.WB Saunders.Philadelphia.PA:p299-321.1996
- Mader DR ed.Reptile Medicine and Surgery 2nd ed.Saunders Elsevier.2006
- Malik SK,Jenkins DE.Alteration in airway dynamics following inhalation of ultrasonic mist.Chest62:660-664.1972
- Moberly WR.The metabolic responses oUlle common iguana, lIguana iguana, to activity under restraint.Compo Biochem. Physiol21:1-20.1968
- O’Malley B.Hospitalisation & Treatment of Snakes, Lizards, CheloniansWorld Small Animal Veterinary Association World Congress Proceedings.2011
- O’Malley B.Clinical Anatomy and Physiology of Exotic Species:Structure and Function of Mammals,Birds,Reptiles,and Amphibians. Elsevier Saunders.2005
- Parkinson LA,Mans C.Evaluation of subcutaneously administered electrolyte solutions in experimentally dehydrated inland bearded dragons (Pogona vitticeps).Am J Vet Res81(5):437-441.2020
- Pough fH,Andrews RM.Use of anaerobic metabolism by free-ranging lizards.Physiol Zool58:205-213.1985
- Prezant RM,Jarchow JL.Lactated fluid therapy use in reptiles:Is there a better solution? In Proc Assoc Reptil Amphib Vet, Houston, TX:p83.1997
- Rees Davies R,Klingenberg RJ.Therapeutics and medication.BSAVA Manual of Reptiles10:p115-131.2004
- Scott DW,Miller WH,Griffin CE.Muller & Kirk’s Small Animal Dermatology 6th.WB Saunders.2001
- Schumache J.Reptile respiratory medicine.Vet Clin North Am Exot Anim Pract6(1):p213-231.2003
- Schad C.Fluid therapy in reptiles.Veterinary Clinics of North America:Exotic Animal Practice13(1):75-87.2010
- Sismour EN,Fecteau KA,Valdes-Solis EV.Evaluation of subcutaneously administered electrolyte solutions in experimentally dehydrated inland bearded dragons (Pogona vitticeps). American Journal of Veterinary Research81(5):437-443.2020
- Sykes JM.Fluid Therapy in Reptiles.In Mader’s Reptile and Amphibian Medicine and Surgery 3rd:p499-506.Elsevier.2020
- Stampe MA et al.Pharmacokinetics of ceftazidime in loggerhead sea turtles (Caretta caretta) after single intravenous and intramuscular injections.Clinical TrialJ Zoo Wildl Med30(1):32-5.1999
- Thorson TB.Boely fluid partitioning in reptilia.Copeia:p592-601.1968
- Varga M.Captive maintenance and welfare. BSAVA Manual of Reptiles 2nd.2:6-18.2004
- Wilkinson R.Reptile medicine and surgery in practice.Butterworth-Heinemann.2004


