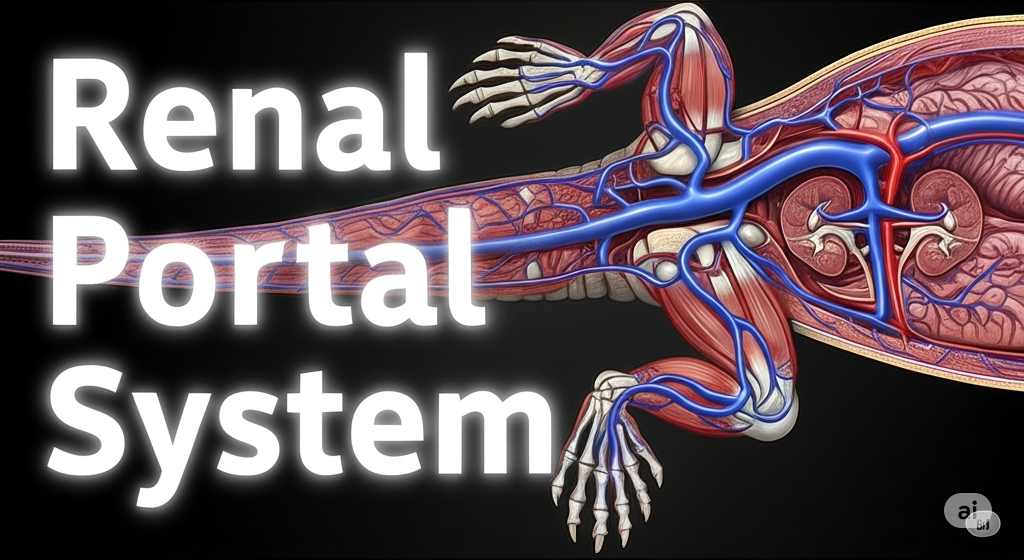
要約
爬虫類は哺乳類と異なり、後肢および尾部からの静脈血の一部を全身循環の前に腎臓の尿細管周囲の毛細血管へ直接灌流させる腎門脈系 (Renal Portal System)を有します。この独自の循環系は、尿細管における水分再吸収や尿酸排泄を効率化する生理的役割を担う一方で、臨床獣医学、特に薬物投与において重要な意味を持ちます。尾部や後肢に投与された薬剤は、腎門脈系を介して高濃度で腎臓に達し、期待される全身効果を発揮する前に排泄されたり(腎初回通過効果)、腎毒性を引き起こしたりする可能性があります〔Holz 1997〕。そのため多くの獣医師は、爬虫類への注射を前肢に行うよう教育されてきました。爬虫類の臨床診療において、適切な薬剤投与経路の選択は治療成功の鍵となります。
生理
腎門脈系の主な生理学的機能は、糸球体濾過とは独立して尿細管へ血液を供給することで、水分再吸収の促進や尿酸の排泄において利点があると考えられています〔Stahl 2019〕。脱水時には下垂体からアルギニンバソトシン(AVT) が分泌され、AVTは遠位尿細管の水分透過性を高めると同時に、糸球体血流量を減少させますが、尿細管への血流を維持して効率的な水分再吸収を可能にします〔Stahl 2019,Dantzler et al.1996,Dantzler 1985〕。そして、爬虫類の主要な窒素代謝産物である尿酸は、糸球体濾過に加え、尿細管から活発に分泌されます。腎門脈系による豊富な血流は、この尿細管分泌をサポートすると言われています〔Holz 2020〕。
解剖
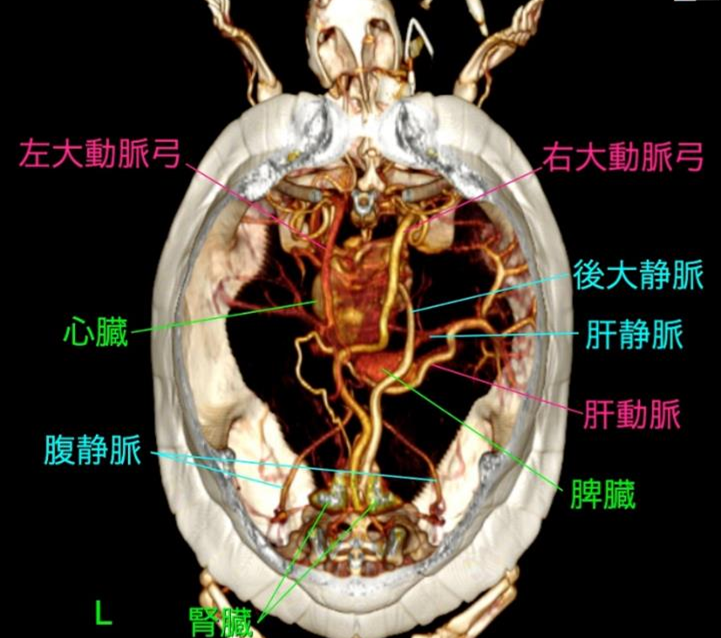
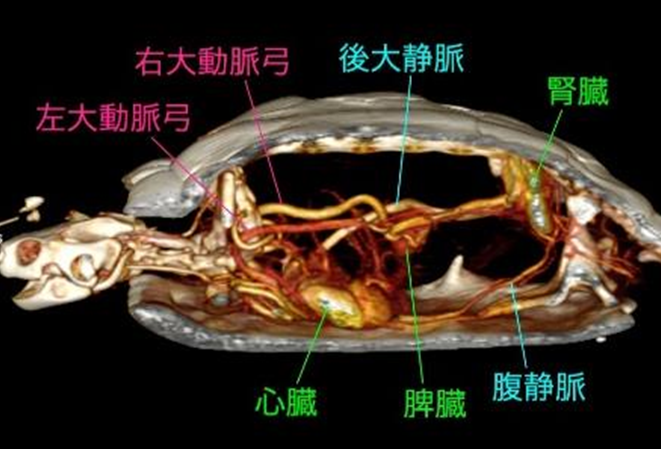
腎門脈系は、後肢、骨盤領域、尾部からの静脈血を集め、腎臓に流入する血管系ですが、主要な構成血管は爬虫類の種類によって若干異なります。そして、種類による血管解剖の相違はもちろんのこと、これまで各血管の名称もバラバラにつけられ、未だに正式名称も定義されていません。そのため、腎門脈系の解剖や生理を理解する上でのデータを解釈することが、難しくなっています。本稿では、アカミミガメに関するHolzら(1998)による研究結果を参考に解説します。
後肢からの流入
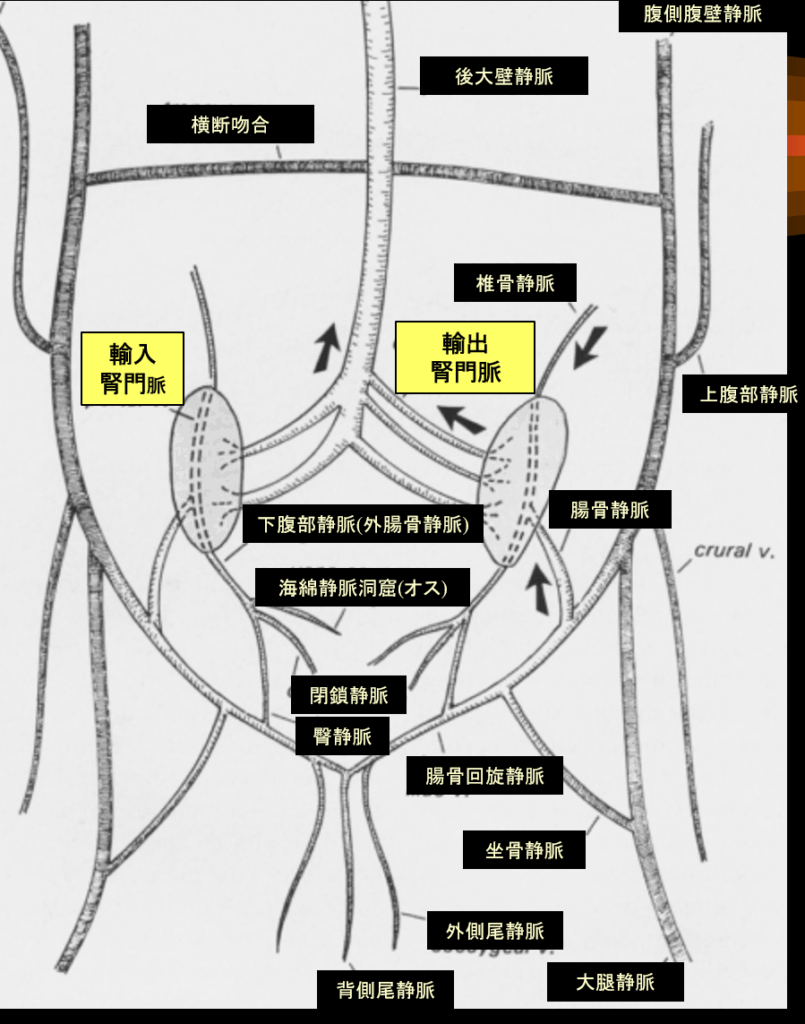
大腿静脈(Femoral vein)
後肢からの血液を集める主要な静脈で、左右の大腿静脈は、それぞれの後肢が甲羅に入る場所で体腔に流入しています。これらは、頭側では大腿二頭筋によって、尾側では半腱様筋と半膜様筋によって形成された溝を走行し、腹静脈が腹甲に接する部位でそれぞれ腹静脈に合流します。
坐骨静脈(Ischiodynia vein)
坐骨静脈は、膝関節のすぐ尾側で各大腿静脈から出て、後肢の尾側に沿って前方に走行しています。
尾からの流入
背側尾静脈(Dorsal coccygeal vein)
尾椎の背側い沿って頭側に奏功し、分岐して2本の腸骨回旋静脈を形成し、左右の殿筋の背側に沿って頭側に続く血管です。
腎臓への流入とバイパス
腸骨静脈 (Iliac vein)
腎臓へ血液を運ぶ経路の一部です。下腹部静脈が内腸骨静脈とも呼ばれることから、外内腸骨静脈という名称が使われることも多いです。
腸骨回旋静脈 (Circumflex iliac vein)
腸骨回旋静脈は尾静脈からの血液を受け、腎臓または腹側腹壁静脈へ分岐する重要な静脈です。左右の腸骨回旋静脈は前方に分岐し、内側枝は腸骨静脈を形成、外側枝は腹側腹壁静脈に移行します。
腹側腹壁静脈 (Ventral Abdominal vein)
体の後部からの静脈還流における極めて重要な代替経路として存在します。この静脈は、後肢から(大腿静脈や骨盤静脈を介して)血液を受け取り、腎臓をバイパスし、肝臓へ直接血液を運ぶ非常に重要なシャント(短絡路)になります。通称で腹静脈と呼ばれることが多いです。左右の腸骨回旋静脈の外側枝は腹静脈になり、腹甲の内表面に沿って体腔膜内を正中線の両側約1cmの領域を浅く進んで肝臓に入り、1本は右葉を、もう1本は左葉を貫通し、肝臓内で肝門脈に繋がっています。腹静脈を起始部から肝臓に向かって辿ると、多数の静脈がそこに流入し、2本の腹静脈を結ぶ横行腹静脈は、骨盤のすぐ前方で連絡をしています。
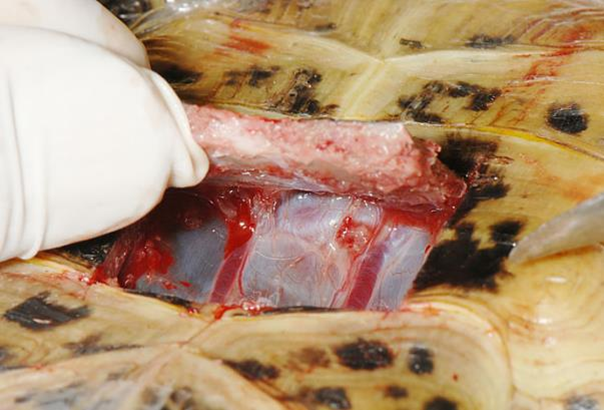
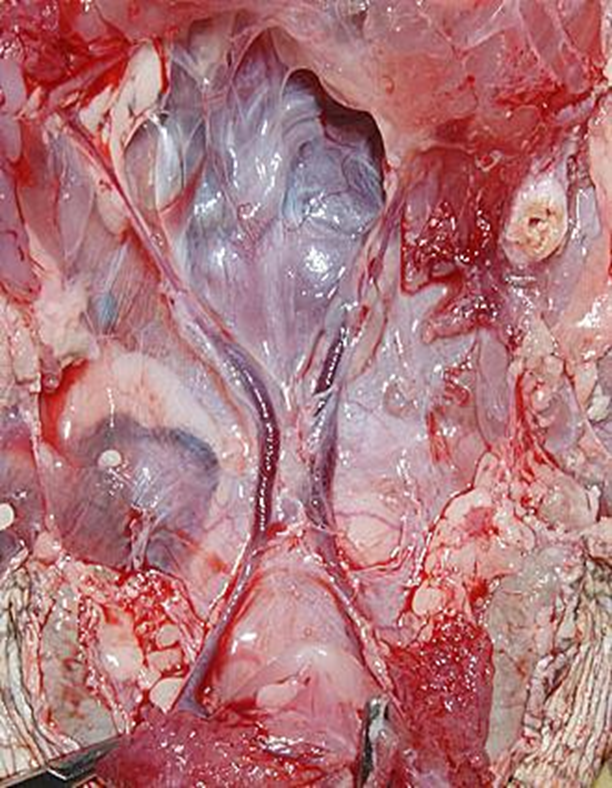
カメの腹側腹壁静脈は対になっているのに対し、有鱗目は途中から1本に合流します〔Holz 1999〕。
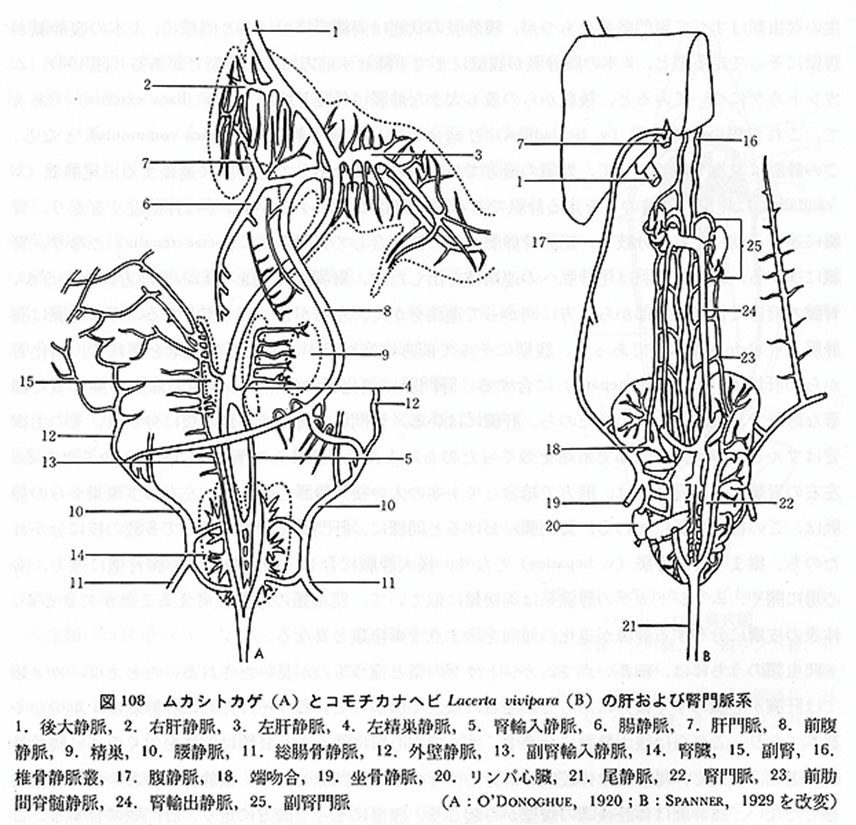
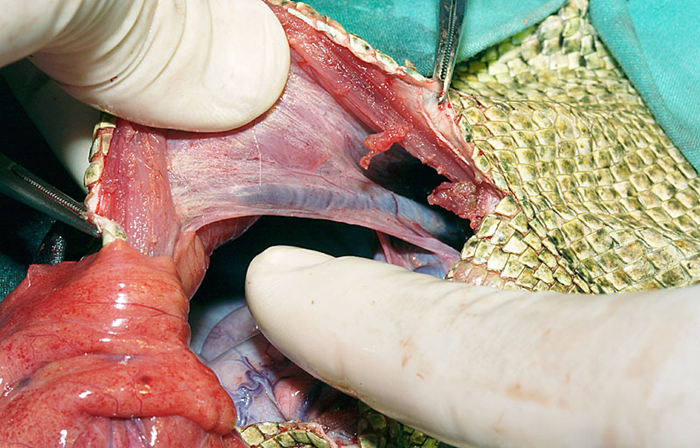
下腹部静脈(内腸骨静脈)(Hypogastric vein)
左右の下腹部静脈はそれぞれの腎臓の後葉に流入します。オスでは、これらの静脈は内側から太い短い海綿静脈洞を介して陰茎から、外側からは直径の小さい閉鎖静脈を介して血液を受け取り、外側からは骨盤の筋肉から血液を受け取ります。メスには左右の卵管静脈が存在し、卵管からそれぞれの下腹静脈へと血液を排出しています。腎臓に接触すると、下腹静脈は輸入門脈と呼ばれ、各腎臓の腹側に沿って走行します。
輸入腎門脈 (Afferent renal portal veins)
腎臓の実質へ直接血液を供給する血管で、 求心性腎門脈とも呼ばれています。腎実質内で広範に分岐し、尿細管(近位および遠位曲尿細管)を直接取り囲む密な毛細血管ネットワーク、すなわち尿細管周囲毛細血管(peritubular capillaries)を形成します 。左右の輸入腎門脈の頭側端は、肋骨弓の背側から始まる同側椎骨静脈からの流入があります。
腎臓からの流出
輸出腎門脈 (Efferent renal portal veins)
腎臓の毛細血管床を通過した血液を集める血管です。右腎の内側からは3本、左腎からは2本の大きな門脈枝が伸びていました。これら5本の静脈は正中線で融合して後大静脈を形成しています。
後大静脈 (Postcaval vein)
輸出腎門脈からの血液が合流し、肝臓の右葉を横断して肝静脈還流を受け、心臓の右心房に注ぎ込みます。
後肢や尾からの静脈は合流し、腎門脈を形成して左右の腎臓に向かい、腎臓内で尿細管を取り囲む毛細血管網に分岐します。その後、血液は腎静脈を経て後大静脈に合流し、心臓へと戻ります〔Stahl 2019〕。種類によって血管構造も異なりますが、カメとトカゲでは比較的典型的な構造を持ち、後肢からの腸骨静脈と尾からの尾静脈が明瞭に腎門脈を形成します〔Benson et al.1999〕。ヘビでは後肢を欠くため、体の後方からの体壁静脈と尾静脈が腎門脈の主たる流入路となります。細長い体への解剖学的適応として、左右の腎臓は非対称に位置して、細長い葉状構造を持ちます 。腎門脈は尾静脈から形成され、腎臓に沿って走行し、支流を受けながら尿細管周囲の毛細血管を灌流しています。腹側腹壁静脈系は、トカゲやカメに比べて優位性が低いか、構造が異なります。このため、ヘビにおける腎門脈系は、他の目と比較して、生理学的および薬理学的にはるかに大きく、より直接的な重要性を持っています。ワニはは基本構造は他と同様ですが、より複雑な吻合が見られることがあります。
腎門脈弁
後肢、骨盤領域、尾部からの静脈血は、腎臓へ向かう経路(腎門脈経路)以外に、途中の血管で肝臓へ向かうシャントが存在します。この血流の方向転換は、大腿静脈と腹側腹壁静脈の接合部付近に存在する腎門脈弁(Renal portal valve) によります。この弁の開閉により、血液が腎臓を通過するか、あるいは腹側腹壁静脈を通って肝臓へバイパスされるかが調節されます。この制御は、動物の水分補給状態など生理的な要因に影響される可能性があります。カメやトカゲに見られる肝臓へのシャントは、無肢で細長い体を持つヘビ類における腎臓への主要な経路とは著しい対照をなします。カメやトカゲにおける大きな腹側腹壁静脈は、血液を貯留する容量血管としての役割も果たしている可能性があり〔Benson et al.1999〕、流線型のヘビの体ではその役割の重要性は低いかもしれません。鳥類の腎門脈弁は、総腸骨静脈内に明確な筋肉によって制御され、この弁は神経支配を受けており、血液を腎臓内か後大静脈へと能動的に振り分けます〔Buyse et al.2025〕。この弁は平滑筋で構成され、交感神経(アドレナリン作動性)の支配を受けています〔Stah 2019〕。保定や恐怖などのストレにより血中のカテコールアミン濃度が上昇すると、この弁が収縮・閉鎖します〔Rennick et al.1954〕。その結果、後肢や尾からの静脈血は腎臓をバイパスし、直接後大静脈へと流入します。逆に、副交感神経(コリン作動性)の刺激は弁を弛緩・開放させ、腎臓への血流を促進します〔Rennick et al.1954〕。この弁の存在は、後肢に投与された薬剤の動態を考える上で非常に重要になります。これに対し、爬虫類における腎門脈弁はより曖昧です。一部の文献では弁の存在が言及されていますが 、カメにおける詳細な解剖学的研究では、鳥類に見られるような独立した筋性弁は発見されませんでした〔Holz et al.1998〕。その代わりに、腹側腹壁静脈と大腿静脈の接合部に、受動的な膠原線維性の内膜突起が見出されています。これらは血行動態的に血流に影響を与える可能性はありますが、鳥類の弁のように能動的に制御されるものではありません。しかし、爬虫類は血圧がはるかに低い(ニワトリの拡張期血圧120mmHgに対して20mmHg)ため、このような弁は鳥ほど頑丈である必要はないと考えられます〔Rodbard et al.1946〕。このような弁が開いている場合、腸骨回旋静脈を流れる血液の大部分は、重力によって自然に腹側の腹静脈へと流れ込みます。腹静脈と大腿静脈の接合部にある弁が閉じている場合にのみ、尾側の腹静脈の静水圧が上昇し、腎臓を灌流するために、血液は重力に逆らって背側に腸骨静脈へと送られるという考えもあります〔Holz 1998〕。結論的には、爬虫類での腎門脈弁としての機能する因子は不明です。
臨床的意義と薬剤動態
腎門脈系の存在は、特に薬物投与において代謝排泄されるか、毒性が発生するかの2つの臨床的な懸念を生じます。
腎初回通過効果 (Renal First-Pass Effect)
薬剤が全身循環に到達する前に、腎臓で代謝・排泄され、血中濃度が意図したレベルに達しない可能性があります。
腎毒性 (Nephrotoxicity)
腎毒性を持つ薬剤が、全身に希釈されることなく高濃度で直接腎尿細管細胞に曝露されることによる、腎障害のリスク増大します。
このため、伝統的に「爬虫類への注射は体の前半部(前肢など)に行うべきであり、後半部(後肢や尾)は避けるべきである」とされてきました〔McDaniel et al.2021〕。特にアミノグリコシド系抗生物質(ゲンタマイシン、アミカシンなど)のように、腎毒性が知られ、かつ尿細管から排泄される薬剤の投与には細心の注意が必要です。しかし、近年の研究では、この「後半部への注射回避」という原則は、必ずしも全ての薬剤に当てはまるわけではないことが示唆されています。Holzら (1997) がアカミミガメを用いて行った研究では、尿細管分泌によって排泄されるカルベニシリンの薬物動態は注射部位(前肢と後肢)によって影響を受けましたが、主に糸球体濾過で排泄されるゲンタマイシンの動態には有意な差が見られなかったそうです。この結果の背景には、前述の腎門脈弁の機能が関与している可能性があります。診察時のストレスによって弁が閉鎖し、血流が腎臓をバイパスした場合、理論上の腎初回通過効果は起こりにくくなります。また、薬剤の種類(尿細管分泌型か、糸球体濾過型か)、動物の状態(脱水、ストレスの有無)、体温など、多くの要因が複雑に関与するため、一概に「後半部への注射は危険」と断定することはできません〔McDaniel et al.2021〕。以上の知見を踏まえ、現在の臨床における推奨は以下のようにまとめられています。

- 原則として前肢投与を第一選択とする: リスクを完全に排除するため、特に初診個体や状態の悪い個体に対しては、前肢やその近傍の皮下・筋肉内投与が最も安全です。
- 腎毒性の高い薬剤は後半部への投与を厳禁する: アミノグリコシド系抗生物質など、腎毒性が既知の薬剤は、いかなる場合も後半部への投与を避けるべきです。
- 後半部に投与せざるを得ない場合の考慮: 動物が大型で保定が困難な場合など、やむを得ず尾部などに投与する際は、腎初回通過効果や腎毒性のリスクが低い薬剤を選択します。また、投与時の動物のストレスを最小限に抑える工夫が求められるます。
進化と腎門脈の発生
門脈系とは、ある毛細血管床から集められた血液が、心臓に戻る前に門脈と呼ばれる血管を通って別の毛細血管床を通過する血管配置として定義されています。この概念の典型例は肝門脈系であり、消化管から栄養素を豊富に含んだ血液を集め、肝臓での代謝処理のために輸送する役割を担います。腎門脈系は、多くの非哺乳類脊椎動物に見られる、肝門脈系とは異なる第二の門脈循環になります 。腎門脈系の系統発生学的分布を詳述すると、その存在は魚類(ヌタウナギ類とヤツメウナギ類を除く)、両生類、爬虫類、鳥類で確認される一方、哺乳類では完全に欠如しています 。この分布パターンは、腎門脈系が脊椎動物の祖先的な特徴であり、哺乳類の進化の過程で失われたことを示唆しています。哺乳類における腎門脈系の欠如は、濃縮尿(高張尿)を生成するという独自の水分保持戦略の鍵となるヘンレのループの進化と密接に関連しています。爬虫類はヘンレのループを持たず、高張尿を生成できません 。彼らの主要な水分保持戦略は、不溶性の尿酸を排泄することにあります。この尿酸の排泄は、糸球体での濾過よりも、尿細管での能動的な分泌に大きく依存しています 。腎門脈系は、この分泌機能を担う尿細管へ直接、大量かつ低圧の血液を供給するのに理想的なシステムになります 。尿酸は水に溶けにくく、糸球体での濾過よりも、近位尿細管による能動的な分泌によって大部分が排泄される 。脱水が起こると爬虫類は糸球体濾過率が低下しますが、腎門脈系は腎尿細管への唯一の血液供給源となります 。この門脈血流は、尿細管細胞の虚血性壊死(酸素不足による組織の死)を防ぐために不可欠で、濾過が停止している間も尿細管分泌を継続させることを可能にします。ここで決定的に重要なのは、この門脈血供給が、主に糸球体を灌流する腎動脈からの動脈血供給とは別個のものであるという点である 。この二重の血液供給システムこそが、本稿で詳述する解剖学的・生理学的概念の中心をなす。これこそが、腎門脈系を乾燥環境での生存と結びつける鍵となる生理学的メカニズムになります。
待望の新刊! 爬虫類の病気百科
エキゾチックアニマル臨床の第一人者 霍野晋吉が贈る、獣医師そして飼育者、ブリーダーまで、全爬虫類関係者へ送る医学バイブル
引用文献
- Buyse K et al.On the function and origin of the avian renal portal shunt and its potential significance throughout evolution.Biol Rev Camb Philos Soc100(1):351-361.2025
- Benson KG,Forrest L.CHARACTERIZATION OF THE RENAL PORTAL SYSTEM OF THE COMMON GREEN IGUANA (IGUANA IGUANA) BY DIGITAL SUBTRACTION IMAGING.Journal of Zoo and Wildlife Medicine 30(2):235-241.1999
- Dantzler WH,Schmidt-Nielsen B.Excretion in fresh-water turtle(Pseudemys scripta) and desert tortoise(Gopherus agassizii).Am J Physiol210:198-210.1996
- Dantzler WH.Comparative aspects of renal function.In The Kidney:Physiology and Pathophysiology.Seldin DW,Giebisch G eds.1985
- Holz P.Barker IK,Burger JP,Crawshaw G,Conlon JM.The effect of the renal portal system on pharmacokinetic parameters in the red-eared slider (Trachemys scripta elegans).Journal of Zoo and Wildlife Medicine28(4):386-393.1997
- Holz PH.The anatomy and perfusion of the renal portal system in the red-eared slider (Trachemys scripta elegans).Journal of Zoo and Wildlife Medicine 28(4):378-85.1998
- Holz PH.Anatomy and Physiology of the Reptile Renal SystemReviewVet Clin North Am Exot Anim Pract23(1):103-114.2020
- Holz PH.The reptilian renal portal system—a review.Bull ARAV9(1):4–14.1999
- McDaniel MS.Gaskins J,Sykes JM.Reptile and Amphibian Pharmacology.Veterinary Clinics:Exotic Animal Practice24(1):1-21.2021
- Rennick BR,Gandia H.Pharmacology of smooth muscle valve in renal portal circulation of birds.Proc Soc Exp Biol Med85:234-236.1954
- Rodbard S,Feldman D.Relationship between body temperature and arterial pressure.Proc Soc Exp Biol Med63:43-44.1946
- Stahl SJ.Anatomy and Physiology of the Reptile Renal System.Veterinary Clinics of North America: Exotic Animal Practice22(3):357-375.2019